下列有关化学反应速率的说法中,正确的是( )
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法 |
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br—,然后Br+首先与CH2=CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是


| A.ClCH2CH2Cl | B.BrCH2CH2Br | C.BrCH2CH2I | D.BrCH2CH2Cl |
高温下,某反应达平衡,平衡常数K=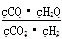 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,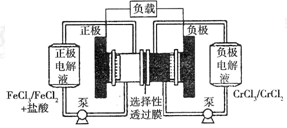
工作原理为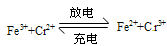 下列说法一定正确的是
下列说法一定正确的是
| A.电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D.电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol·L-1 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上的反应式:O2+4e—+2H2O=4OH- |
关于下列各装置图的叙述不正确的是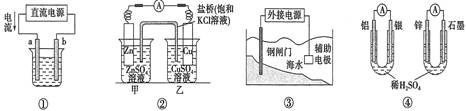
| A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液 |
| B.图②装置中盐桥中的Cl-移向乙烧杯 |
| C.图③装置中钢闸门可与外接电源的负极相连受到保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |