选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、加热分解 B、结晶法 C、分液法 D、蒸馏法 E、过滤法 F、萃取法
(1) 分离饱和食盐水和沙子的混合物
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾(溶解度差异很大)
(3) 分离水和汽油的混合物
(4) 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)
(5) 从碘水中提取碘
现有下列物质:
①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡
⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的电解质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(4)在水溶液中,不能完全电离的是 ;
(10分))对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增加或减少,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① |
HF |
Ka=6.8×10-4 mol•L-1 |
| ② |
CH3COOH |
Ka=1.7×10-5 mol•L-1 |
| ③ |
HCN |
Ka=6.2×10-10 mol•L-1 |
| ④ |
H2CO3 |
Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是、。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:_________________,
足量的CO2通入NaCN溶液中:______________。
,为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为1.1g∙cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题: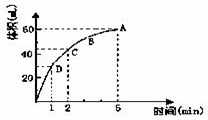
(1)实验时放出气体的总体积为_________。
(2)放出一半气体所需要的时间为_________。
(3)ABCD四点化学反应速率的由快到慢顺序为_________。
(4)在5min后,收集到的气体体积不再增加,原因是_________。
(6分)“嫦娥二号”卫星于2010年10月1日18时59分57秒在西昌卫星发射中心发射升空,并且获得了圆满成功。火箭推进器中装有强还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合反应时,产生大量氮气和水蒸气,并放出大量的热.已知0.4 mol液态肼与足量的液态H2O2反应生成氮气和水蒸气,放出256.652 kJ的热量.
(1)反应的热化学方程式为_________________________________________________
(2)又知H2O(l)===H2O(g) ΔH=+44 kJ/mol,则16 g液态肼与足量液态过氧化氢反应生成液态水时放出的热量是_______ kJ.
(3)此反应用于火箭推进,除释放出大量的热和快速产生大量气体外,还有一个很大的优点是________________.