【化学—选修3:物质结构与性质】
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子,L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是_______________,该原子核外电子排布式是_______________,其最高正价氧化物对应的水氧化物的化学式是_______________;
(2)元素X与Y形成的化合物晶体类型是晶体_________,1mol该化合物含有的化学键数为___________(用阿伏加德罗常数NA表示);
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是________,该化合物中X的原子的杂化轨道类型是____________;
(4)X与碳、氢、三种元素形成的相对分子质量最小的分子里有个____δ键,____个π键;
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为______。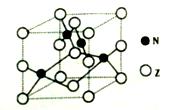
已知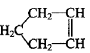 可简写为
可简写为
I.降冰片烯的分子结构可表示为: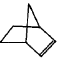
(1) 降冰片烯属于__________。
a. 环烷烃 b. 不饱和烃 c. 烷烃 d. 芳香烃
(2)降冰片烯不具有的性质__________。
a. 能溶于水 b. 能发生氧化反应
c. 能发生加成反应 d. 常温常压下为气体
II.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为,系统命名为。
(2) 四环烷(Q)一氯代物共有种。
(Ⅰ)某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如下:
请填写下列空白:
(1)A的化学式是。
(2)振荡的目的是。
(3)分液操作需要的玻璃仪器有。
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式:。
(Ⅱ)甲苯和溴乙烷混合物可通过如下流程进行分离。
请填写下列空白:
(1) 试剂A的名称为。
(2)写出在甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式:。
(14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ="===" 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向(填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是。若电解电路中通过2mol电子,MnO2的理论产量为。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下: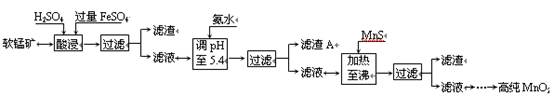
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为。
②加入MnS的目的是除去杂质。
I.某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下: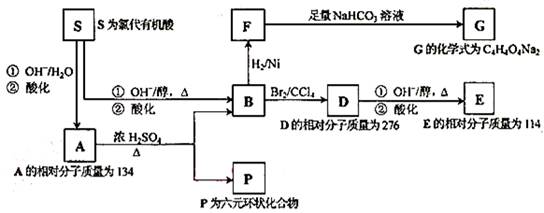
(1)写出下列反应的反应类型: B→D、D→E第①步反应。
(2)B所含官能团的名称是。
(3)写出P、E的结构简式 P、E。
(4)写出在催化剂存在并加热条件下,F与乙二醇缩聚反应生成高分子的化学方程式_________。
(5)写出符合下列要求的D同分异构体结构简式______________。
①与D具有相同官能团②核磁共振氢谱有2个吸收峰,峰面积比为1:1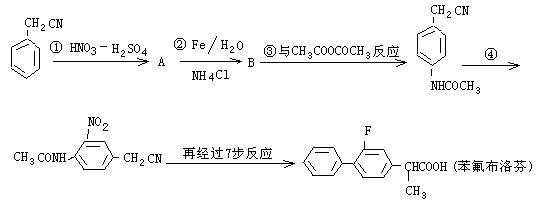 Ⅱ.下面是某研制人员为合成药物苯氟布洛芬所设计的线路
Ⅱ.下面是某研制人员为合成药物苯氟布洛芬所设计的线路
已知: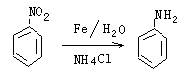
(1)苯氟布洛芬的分子式为__________(2)物质B的结构简式为___________。
(3)反应①~④中属于取代反应的是__________(填反应代号)。
(4)写出反应③的化学方程式_______________________________。
下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。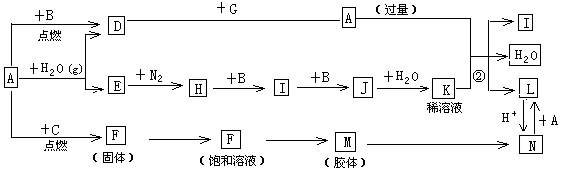
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
②请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下: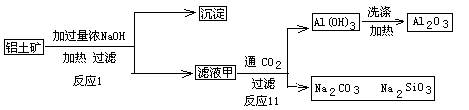
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—