铅及其化合物在工业生产生活中都具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)↑H="a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)↑H="b" kJ•mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)↑H="c" kJ•mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=_____________kJ•mol-1(用含a,b,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g) Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H____0(选填:“>”“<”“=”)。
②当lgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为_______。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为_______。

(4)PbI2:可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图).加入酚酞指示剂,用0.0025mol•L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时PbI2 Ksp为_______。

(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图1所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图2所示.

①常温下,pH=6→7时,铅形态间转化的离子方程式为____________________。
②用活性炭处理,铅的去除率较高时,铅主要应该处于________(填铅的一种形态的化学式)形态.
(16分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)∆H=kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)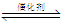 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H0,(填“>”或“<”)。
若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将(填“增大”、“减小”或“不变”)。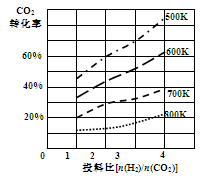
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)=。[已知:Ksp(CaCO3)=2.8×10-9]
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象;当燃料电池消耗2.8 L O2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出)。
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。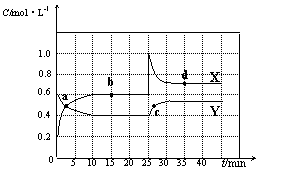
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是;a、b、c、d四个点中,表示化学反应处于平衡状态的点是。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=mol·L-1·min-1。
②反应2NO2(g) 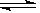 N2O4(g)在b点的平衡常数K(b)=。
N2O4(g)在b点的平衡常数K(b)=。
③反应2NO2(g) 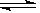 N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d)K(b)(填“>”、“=”或“<”)。
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d)K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是(填序号)。
| A.加入催化剂 | B.缩小容器体积 |
| C.加入一定量的NO2 | D.加入一定量的N2O4 |
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是。
(1)某温度下,纯水中的c(H+)=3×10-7 mol/L,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=__,由水电离出的c(H+)为_____。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是 ______;(填序号)
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②、③混合(填“>”、“<”或“=”);
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③________④ (填“>”、“<”或“=”);
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精⑨氯水 ⑩H2SO4
a.上述物质中可导电的是(填序号,以下同);
b.上述物质中属于非电解质的是。
(1)经元素分析后,发现某烃的含碳量为82.76%,氢的质量分数则为17.24%,且相对分子质量为58,该烃的分子式。
(2)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重7.2g,氢氧化钠溶液增重30.8g。推测它的分子式和结构简式。
(3)某含氧有机物,它的相对分子质量为46.O,碳的质量分数为52.2%,氢的质量分数为33.0%,NMR中只有一个信号,请写出其结构简式。
(4)某有机化合物仅由碳、氢、氧三种元素组成 ,经测定其相对分子质量为90 。称取该有机物样品1.8 g ,在足量纯氧中完全燃烧 ,将产物先后通过浓硫酸和碱石灰 ,两者分别增重1.08 g和2.64 g 。该有机物的分子式。
请根据官能团的不同对下列有机物进行分类。
(1)芳香烃:;(2)卤代烃:;
(3)醇:;(4)酚:;
(5)醛:;(6)酮:;
(7)羧酸:; (8)酯:。