短周期元素A、B、C、D、E,A为原子半径最小的元素,A、D同主族,D、E同周期,CE同主族且E的原子序数为C的原子序数的2倍,B为组成物质种类最多的元素。
(1)E离子的原子结构示意图__________________;
(2)分别由A、C、D、E四种元素组成的两种盐可相互反应得到气体,写出这个反应的离子方程式__________________;
(3)由A、B、C三种元素组成的物质X,式量为46,在一定条件下与C、D两种元素的单质均可反应.写出X与C单质在红热的铜丝存在时反应的化学方程式__________________;
(4)A、C、D三种元素组成的化合物Y中含有的化学键为_______________,B的最高价氧化物与等物质的量的Y溶液反应后,溶液显________(“酸”、“碱”或“中”)性,原因是________________;
(5)A的气体单质和C的气体单质可发生反应,在“神舟六号”飞船上使用了根据这反应设计的燃料电池,电解质溶液为KOH溶液,电池负极反应为__________,使用这种电池的优点为_____________;
如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体,
试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式____________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:_________________________ 。
(1)用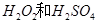 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: ====
==== △H=+64kJ/mol
△H=+64kJ/mol ====
====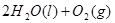 △H= -196kJ/mol
△H= -196kJ/mol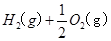 ="==="
="==="  △H= -286kJ/mol
△H= -286kJ/mol
在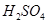 溶液中
溶液中 与
与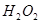 反应生成
反应生成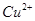 和
和 的热化学方程式为 。
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅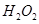 和3.0 mol/L的
和3.0 mol/L的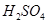 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
| 铜平均溶解速率 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
|
(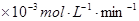 ) ) |
||||||||
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的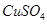 溶液中加入一定量的
溶液中加入一定量的 和
和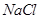 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。
(6分)某课外活动小组同学用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与b连接,则B极的电极反应式为。
总反应的离子方程式为。
有关上述实验,下列说法正确的是(填序号)。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为
。
15.6 g Na2X含Na+ 0.4mol,则Na2X的摩尔质量为,X的相对原子质量为 。
写出下列物质在水中的电离方程式:
(1)硫酸钠
(2)氢氧化钡