(6分)某课外活动小组同学用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与b连接,则B极的电极反应式为 。
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为
。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用,但硫的氧化物直接排放到大气中会造成污染。
(1)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用右图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
(2) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①写出图中由2到3段的反应离子方程式 。
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 (用离子方程式表示)。
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水一般采用氧化法,常用的氧化剂有氯气、二氧化氯、次氯酸盐双氧水等。
(1)工业上常用双氧水处理含CN-离子浓度较低的废水,流程如下: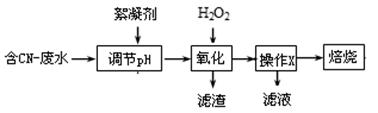
操作X的名称为 。滤液中常含有H2O2,排放前需除去,写出除去H2O2的方法
(2)实验室中可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。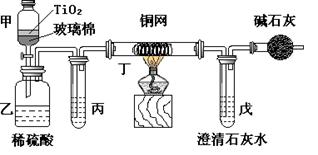
回答下列问题:
①乙中反应的离子方程式为 。丁在实验中的作用是 。
②乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 | C.浓NaOH溶液 | D.浓硫酸 |
③若该测得值与实际处理的百分率相比偏低,请简要说明可能的原因 。请提出一个能提高准确度的建议(具体操作) 。
④处理后的溶液,主要含有HClO、Na+、H+、Cl-等,请设计实验证明溶液中含有HClO和H+的实验方案:
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液;
②量取25.00 mL溶液,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)NaxFey(SO4)m(OH)n中x、y、m、n的代数关系式为 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
化学物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下: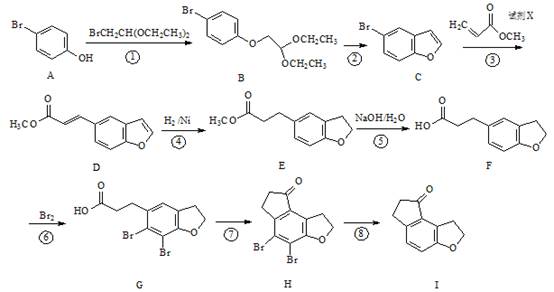
(1)反应④——⑧反应反应中,不属于取代反应的是 (填序号)。
(2)物质G中含氧官能团的名称为 、 。
(3)反应③中加入的试剂X的分子式为C4H6O2,X的结构简式为 。
(4)写出同时满足下列条件的物质I的一种同分异构体的结构简式 。
①能发生银镜反应;且水解产物之一能与FeCl3溶液发生显色反应。
②分子的核磁共振氢谱有5个峰,且分子中含有苯环。
(5)已知: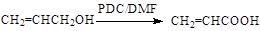
以 、
、 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用)。合成流程图示例如下:
,写出合成流程图(无机试剂任用)。合成流程图示例如下:
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示: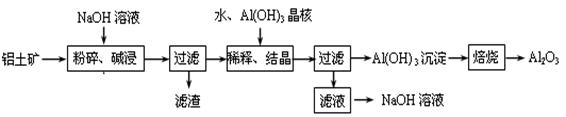
(1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是 。碱浸时AlO(OH)与NaOH反应的化学方程式为 。滤渣的主要成分为 (填化学式)。
(2)上述“稀释、结晶”工艺后,溶液的pH将 (填“增大”、“减小”或“不变”)。
也可用通入足量的CO2气体的方法来代替,其原因是 (用离子方程式表示)。
(3)在空气中浓缩所得的NaOH溶液,得到的浓溶液中会混有杂质,该杂质可能为 。