反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_________反应(填“吸热”或“放热”);
反应热△H=_______;(用E1、E2表示)
(2)反应体系中加入催化剂对反应热是否有影响? _________,原因是_______________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填 “增大”、“减小”或“不变”)。
物质有以下转化关系: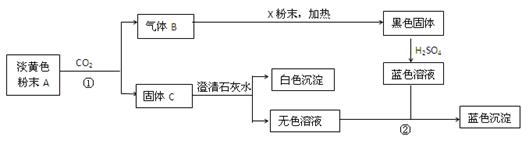
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是,B是,C是,X粉末是。
(2)写出反应①的化学方程式。
(3)写出反应②的离子方程式。
某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、
HCO3-、OH-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有;
(2)当生成AlO2-时,可存在的离子有。
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与
Al2(SO4)3的物质的量浓度之比为 ___________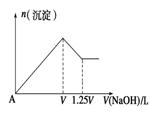
⑴在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂; 元素被氧化; ________是氧化产物;7mol HCl参与反应时转移的电子总数为_____mol.
⑵反应11P +15CuSO4 +24H2O = 5Cu3P + 6H3PO4 +15H2SO4中32g CuSO4能氧化磷的质量为_________g.
工业上为了除去铝材表面的自然氧化膜,常常将铝材浸入装有NaOH溶液的碱洗槽中。 碱洗时常有气泡冒出,原因是________________________(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________.
a.NH3b.CO2 c. NaOH d.HNO3