l,2一二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2一二溴乙烷。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2一二溴乙烷。
某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
回答下列问题:
(1)已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2。写出该反应的化学方程式:________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由是___________。
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是_______________。
(4)丙同学对上述实验进行了改进,只通过观察溴水褪色即可证明乙烯的不饱和性,在I和II之间增加如图所示的装置,则A中的试剂为_______,其作用是__________________B中的试剂为___________,其作用是___________________________。
(5)丁同学通过洗涤、蒸馏等操作对装置II中的l,2一二溴乙烷粗品进行了精制。该洗涤操作用到的主要玻璃仪器是_________
某研究性小组借助A-D的仪器装置完成有关实验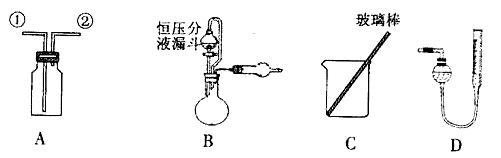
【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),w(Zn) =。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(5)w(Zn) 。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙方案乙(填“优于”、“劣于”或“等同于”)。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。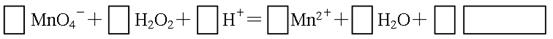
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
| 实验内容 |
实验方法 |
实验现象 |
| 验证氧化性 |
||
| 验证不稳定性 |
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。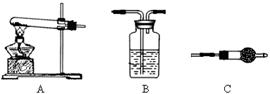
(1)各装置连接顺序为。
(2)能证明生成物中有CuCO3的实验现象是。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。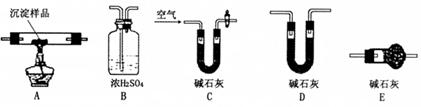
(1)装置C中碱石灰的作用是,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是
(2)若沉淀样品的质量为m克, 装置B质量增加了n克,则沉
装置B质量增加了n克,则沉 淀中CuCO3的质量分数为。
淀中CuCO3的质量分数为。
配制500mL 0.5mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘。
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1cm~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上顺序编出正 确程序。
确程序。
(4)某学生实际配制NaOH溶液的浓度为0.48mol·L-1,不可能的原因是
| A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸 馏水 馏水 |
| C.转移溶液后的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:(1)提出假设:
假设1:该混合金属粉末中除铝外还含有元素;
假设2:该混合金属粉末中除铝外还含有元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案基于假设3,设计出实验方案。(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
||