中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度 /mol.L-1 |
4×10-5 |
6×10-5 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
已知有以下物质相互转化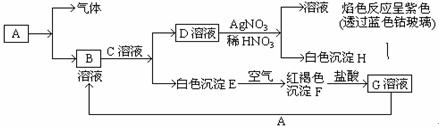
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式。
有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O②B→A + H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
+ H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A,B,C,E 。
。
⑵写出①③④的离子方程式:
①,
③,
④。
2004年国家食品监督局发出公告“警惕油炸食品中的丙烯酰胺(CH2=CH—CONH2)”,丙烯酰胺对人体可造成神经毒性和遗传毒性。下图流程中的有机物K是丙烯酰胺的相邻同系物。
请回答下列问题:
(1)①~⑦反应中属于加成反应的有,属于消除反应的是。
(2)写出反应条件②。
(3)写出结构简式B,H。
(4)写出下列反应的化学方程式:
C→D
E→F
水杨酸是合成阿斯匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:
。
(3)写出水杨酸与碳酸氢钠反应的化学方程式:
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
则阿斯匹林的分子式为;1摩尔阿司匹林完全水解需要氢氧化钠溶液____摩尔。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2)=c(H2O) d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡:②加入少量灼热的碳粉,则平衡:__
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性____,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是。