工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁元素的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【问题讨论】用下图所示装置进行实验:

A B C D E F
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 、 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式 。
(5)B装置的作用是 。
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前 。 ②停止加热后 。
(7)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
| 铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 铁的质量分数 |
77.8% |
70.0% |
72.4% |
(8)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
② 实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 。
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会 (填“偏小”、“不变”或“偏大”)。
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 。
某化学兴趣小组用下图装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。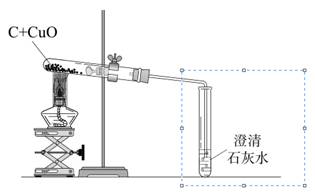
【提出问题】木炭与氧化铜反应生成的红色固体中含有什么物质?
【查阅资料】木炭与氧化铜反应也可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与稀硫酸反应:Cu2O+H2SO4 Cu+CuSO4+H2O。
Cu+CuSO4+H2O。
【进行猜想】木炭与氧化铜反应生成的红色固体成分:
①全部是铜; ②全部是; ③是两者的混合物。
【实验探究】
(1)用上图装置完成木炭还原氧化铜的实验,观察到澄清石灰水。
(2)试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体成分进行探究:
| 步 骤 |
现 象 |
结 论 |
| ①取1.8g红色固体于试管中, 滴加足量,充分反应 |
猜想①错误 |
|
| ②过滤,将滤渣洗涤、干燥、称量 |
所得固体质量 |
猜想③正确 |
【反思与评价】木炭还原氧化铜的实验中,生成的气体可能含有一氧化碳,为了防止对空气造成污染,可将上图虚线方框内的装置改为(选填字母)。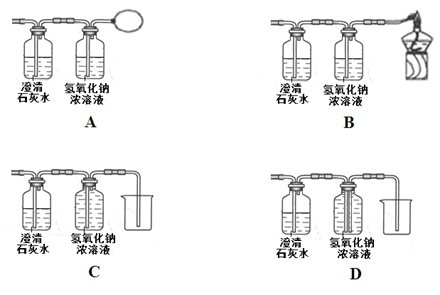
某学习小组围绕“气体实验室制取”进行了研讨。请你参与完成下面的问题。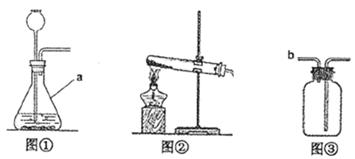
(1)原理分析:实验室制取CO2的化学方程式为。
不用Na2CO3与盐酸反应制取CO2的原因是。
(2)发生装置:图①装置中仪器a的名称是。实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图(填序号)发生装置。
(3)收集装置:实验室收集NH3(极易溶于水)应采用的方法是。收集有毒气体SO2时,常采用③收集装置,气体应从(填字母)端通入。
在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题: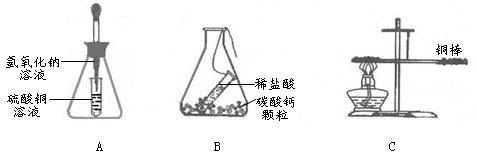
(1)如图A、B所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
①A瓶重新放回到天平上,天平(填“能”或“不能”)保持平衡。
②B瓶重新放回到天平上,天平能否保持平衡?,理由是。
③从原子的角度分析“质量守恒定律” 。
(2)如上图C所示,用细线系住铜棒使之平衡,然后在铜棒一端用酒精灯加热。铜在加热的条件下,能与空气中的氧气反应生成氧化铜。
①写出铜在空气中加热的化学方程式。
②加热一段时间后,铜棒(填“能”或“不能”)保持平衡。
铜制器物在潮湿环境中表面会产生绿色的锈迹,俗称铜绿。某化学学习小组对铜绿成分产生了浓厚兴趣。
【提出问题】铜绿中除铜元素外还有其它什么元素?
【查阅资料】①无水硫酸铜遇水变蓝色;
②碳与一般的酸不反应;
③CuO+H2SO4(稀)=CuSO4+H2O。
【实验探究】该小组同学找到了一些铜绿粉末并进行了如下实验: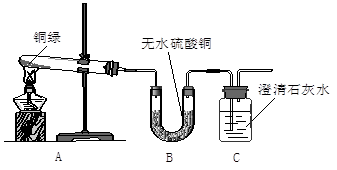
【观察分析】A装置中绿色粉末变为黑色;
B装置中无水硫酸铜变为蓝色;
C装置中澄清石灰水变浑浊,该反应的化学方程式为。
【实验结论】铜绿中除铜元素外还有、和碳等元素。
【交流讨论】根据铜绿的组成,小组同学对A装置中产生的黑色粉末的成分有如下两种不同的猜想:
(1)全部为CuO(2)CuO和C的混合物
【深入探究】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
① |
猜想(1)正确 |
| ②①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
② |
猜想(2)正确 |
【实验结论】化学学习小组同学通过实验证明猜想(1)正确。
【反思应用】根据铜绿中所含元素,可知铜生锈不仅与空气中的氧气、水有关,还可能与空气中的等有关;要保护博物馆里的青铜器,减缓生锈,我们可以减少青铜器与接触。
为粗略测定空气中SO2的含量,某学习小组设计了如下图所示的实验装置进行实验。
【资料】
①室温下,碘的溶解度为0.029g。
②我国空气质量标准中SO2浓度限值(mg/m3)如下表。
| 一级标准 |
二级标准 |
三级标准 |
| 1≤0.15 |
≤0.50 |
0 ≤0.70 |
③SO2+I2+2H2O===H2SO4+2HI。
④SO2可以使酸性KMnO4溶液褪色。
【实验步骤】
①检查气密性;②向C装置中加入1.0 mL溶质质量分数为1.27×10“g/mL的碘水(ρ≈1.0g/mL),滴入2~3滴淀粉溶液;③打开弹簧夹____(填“a”或“b”),关闭另一个弹簧夹,抽拉注射器吸取500 mL空气,再开、闭相应弹簧夹,缓缓推气体进入C装置,重复上述操作多次。当C中溶液颜色____时,停止推动注射器的活塞;④实验数据处理。
请回答下列问题。
(1)完善步骤③的内容:_____________;____________;
(2)检查装置气密性的操作是____,若____,说明装置的气密性良好;
(3)实验时,C装置中原有蒸馏水对实验有无影响?____(填“有影响”或“无影响”);在下列因素中,会使测定结果偏低的是____。
A.推动注射器活塞速率太快
B.长期放置的碘水溶质质量分数低于1.27×10-6g/mL
C.抽取空气时,未抽满500 mL
(4)以下试剂可以代替C装置中碘的淀粉溶液的是____。
A.NaOH溶液B.酸性KMnO4溶液C.蒸馏水 D.酚酞试液
(5)工业上吸收SO2常用足量氨水(用NH3·H2O表示),生成一种相对分子质量为116的盐,反应的化学方程式为______________;还可用石灰乳[Ca(OH)2悬浊液]吸收SO2获得副产品石膏,请补充完整该反应方程式:2SO2+O2+2Ca(OH)2+2H2O===2________。
(6)该小组在同一地点进行了3次实验,推动活塞次数记录如下表(每次抽气为500 mL)。进行3次实验的目的是____;综合3次实验数据分析:该测定地点的空气质量属于____级标准(写出计算过程)。
| 实验序号 |
1 |
2 |
3 |
| 推动次数 |
19 |
20 |
21 |