下表中评价合理的是
| 选项 |
化学反应及离子方程式 |
评价 |
| A |
Fe3O4与稀硝酸反应:2Fe3O4 + 18H+= 6Fe3++ H2↑+ 8H2O |
正确 |
| B |
向MgCO3中加入稀盐酸:CO32- + 2H+ ═ CO2↑+ H2O |
错误,MgCO3不应写成离子形式 |
| C |
向(NH4)2CO3溶液中加入Ba(OH)2溶液: Ba2++CO32-= BaCO3 |
正确 |
| D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++ 2Br-+ 2Cl2 = 2Fe3++Br2+4Cl- |
错误,Fe2+与Br-的化学计量数之比应为1:2 |
铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。 Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实 验方案:
验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色
⑴请你评价方案1和方案2。如果你认为方案合理,请简述其化学原理;如果你认为该方
案不合理,请简述原因。
方案1 :
方案2 :
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。
(2)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有:(填序号)
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题: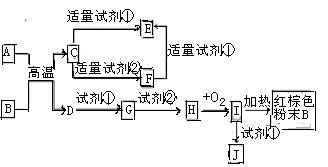
(1)写出物质C的化学式:
(2)写出物质B的一种用途:
(3)以J的饱和溶液制备胶体的操作为 。
。
(4)写出下列反应的方程式:
A→F的离子方程式.
H→I的化学方程式
试剂②可以由一种淡黄色固体粉末和一种常见液体发生反应而制得,其相应的化学方程式
(5)某同学认为J中可能同时含有同一种金属元素的两种阳离子,若要确认其中低价金属阳离子的存在,应选用(选填序号)
A、KSCN溶液和氯水 B、铁粉和KSCN溶液 C、浓氨水 D、酸性高锰酸钾
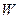 g某元素(无同位素)所含原子数目为
g某元素(无同位素)所含原子数目为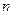 ,该元素原子的摩尔质量为
,该元素原子的摩尔质量为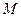 g/mol ,则氯元素的一种同位素
g/mol ,则氯元素的一种同位素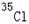 的一个原子的质量是( )(注:该Cl原子的相对原子质量≈35)
的一个原子的质量是( )(注:该Cl原子的相对原子质量≈35)
A.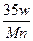 g g |
B.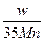 g g |
C.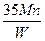 g g |
D.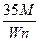 g g |
下列除去杂质的方法正确的是()
| A.除去CO2中的少量SO2:先将气体通入饱和Na2CO3溶液,再收集剩余气体 |
| B.除去NaHCO3溶液中混有的少量Na2CO3(Na2CO3摩尔质量较大):通过蒸馏,收集蒸馏产物 |
| C.除去FeCl3溶液中混有的少量AlCl3溶液:加入足量的NaOH溶液,充分反应后,过滤,向沉淀中加盐酸使其恰好完全溶解 |
D.除去碘水中的I2:加 入乙醇进行多次萃取,留在分液漏斗中的即为较纯净的水 入乙醇进行多次萃取,留在分液漏斗中的即为较纯净的水 |
判断下列说法正确的是()
| A.1molFeCl3跟水完全反应转化为氢氧化铁胶体,其中胶体粒子的物质的量为1mol |
| B.一定温度下,1L0.50mol/L NH4Cl 溶液与2L0.25mol/LNH4Cl溶液含有的NH4+的物质的量不同 |
| C.配制480mL 0.5mol/L 的CuSO4溶液,需要称取60.0g的CuSO4·5H2O晶体 |
| D.10mL质量分数为98% 的H2SO4溶液,用水稀释至100mL溶质质量分数变为9.8% |
(注:硫酸溶液的密度随浓度的增大而增大)