W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是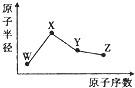
| A.简单离子半径:W>X>Z |
| B.最简单气态氢化物的稳定性:Y<Z |
| C.化合物XZW中既含离子键又含共价键 |
| D.Y的氧化物能与X的最高价氧化物对应的水化物反应 |
下列金属冶炼的反应原理,错误的是
A.2NaCl(熔融)  2Na+Cl2↑ 2Na+Cl2↑ |
B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe3O4+4CO  3Fe+4CO2 3Fe+4CO2 |
D.2HgO  2Hg+O2↑ 2Hg+O2↑ |
25℃时,在某物质的溶液中,由水电离出的H+ 浓度为1´10-amol/
浓度为1´10-amol/ L,下列说法正确的
L,下列说法正确的 是
是
| A.a <7时,水的电离受到抑制 |
| B.a <7时,溶液的PH可能为a |
| C.a >7时,此溶液可能是NH4Cl溶液 |
| D.a >7时,此溶液的PH值一定为14-a |
烧碱、醋酸和碳酸氢钠等是生活中的常见物质。下列有关它们的表达正确的是
| A.将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该混合液中: C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| B.将0.1mol/LCH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、溶液的PH都逐渐增大 |
| C.在碳酸氢钠溶液中加入与其等物质的量的烧碱,溶液中的阴离子只有CO3-和OH- |
| D.常温下,将PH==12的烧碱溶液与PH==2的醋酸溶液等体积混合,所得混合溶液的PH>7 |
某探究小组利用丙酮的溴代反应( )来研究应物浓度与反应速率的关系。反应速率v(Br2)通
)来研究应物浓度与反应速率的关系。反应速率v(Br2)通 过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验序号 |
初始浓度c/mol·l-1 |
溴颜色消失 所需时间t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
| A.增大c(CH3COCH3),v(Br2)增大 | B.实验②和③的v(Br2)相等 |
| C.增大c(HCl),v(Br2)增大 | D.增大c(Br2),v(Br2)增大 |
相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积 变化的曲线如图所示,据图判断正确的是
变化的曲线如图所示,据图判断正确的是

A.Ⅱ为盐酸稀释时pH值变化曲线 |
B.b点溶液的导电性比c点溶液的导电性强 |
C.a点KW的数值比c点KW的数值大 |
D.b点酸的总浓度大于a点酸的总浓度 |