Ⅰ、某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是 。
(3)在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(4)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是______________。
Ⅱ、向盛有KI溶液的试管中加入少许CCl4后滴加氯水, CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式:

(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为橙红色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。据此判断下列反应能否进行HBrO3+HCl→ Br2+Cl2+H2O(未配平) 。(填“能”或“否”)
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L。(标准状况,保留2位小数)
某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。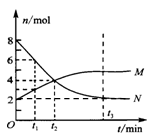
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)=;
某有机物A经分析,含碳的质量分数为90%,含氢的质量分数为10% 。其蒸气相对于氢气的密度为60,则:
(1)有机物A的分子式为:
(2)经红外光谱测知A为苯的同系物,且核磁共振氢谱峰面积比为3:2:2:2:3,则其结构简式为:
(3)有机物A在一定条件下有下列转化关系:
请回答:
①D中含氧官能团名称:
②B→F的反应类型:,高分子化合物H的结构简式:
③E→G的化学方程式:
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。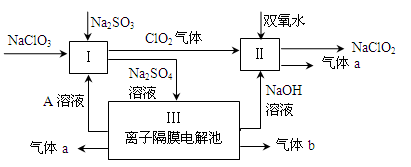
(1)Ⅰ中发生反应的还原剂是(填化学式)。
(2)Ⅱ中反应的离子方程式是。
(3)A的化学式是,气体b的化学式是,装置Ⅲ中发生反应的化学方程式是。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是。
只用试管和胶头滴管就可以鉴别的下列各组溶液是(填序号)
①AlCl3溶液和NaOH溶液②Ca(HCO3)2溶液和NaOH溶液 ③NaAlO2溶液和盐酸
④Al2(SO4)3溶液和氨水⑤AgNO3溶液和氨水
高锰酸钾和氢溴酸溶液可以发生下列反应 KMnO4 + HBr→ Br2 + MnBr2 + KBr + H2O其中还原剂是;若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是mol。