掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称: b.
(2)利用装置I分离四氯化碳和酒精的混合物时,冷凝水由 (填f或g)口通入。
(3)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图。

①图中的错误是 。
②配制溶液时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________。
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度相切
C.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制溶液时下列操作会造成所配溶液浓度偏小的是( )
A.称量后转移固体时不小心把少量固体洒到烧杯外
B.干净的容量瓶又用蒸馏水洗涤了一遍
C.转移过程中不小心把几滴溶液滴在外面
D.加水定容时,俯视容量瓶刻度线读数
如右图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2、HCl和O2。供选用的试剂有:
| A.浓H2SO4 | B.浓盐酸 | C.食盐 | D.二氧化锰 E.KMnO4F.H2O2 |
(1)若要快速制备Cl2应选择______________________________________________;
(2)若要快速制备少量HCl,应选择________________________________________;
(3)若要快速制备少量O2,应选择__________________________________________。
根据图8-8装置进行实验,完成下列问题:
(1)在受热的试管A中Na2O2发生反应的化学方程式:①__________________________,②________________________________。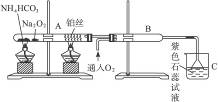
图8-8
(2)被加热的铂丝处发生的化学方程式为:________________________________________。
(3)B中出现的现象为:________________________________________________________。
(4)烧杯C中发生的现象为______________________________________________________。
(5)B管、烧杯C中可能发生的主要反应方程式为__________________________________。
用图1-3所示装置(酒精灯、铁架台等未画出)制取三氯化磷。在具支烧瓶d中放入足量白磷,将氯气迅速而又不间断地通入具支烧瓶中,氯气与白磷就会发生反应,产生火焰。三氯化磷和五氯化磷的物理常数见下表。
| 熔点/℃ |
沸点/℃ |
|
| 三氯化磷 |
-122 |
76 |
| 五氯化磷 |
148 |
200 ℃分解 |
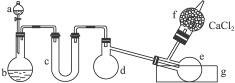
图1-3
(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是:a________,b________。
(2)________(填仪器对应的字母)仪器需要加热。
(3)生成的三氯化磷在蒸馏烧瓶e中收集。为保证三氯化磷蒸气冷凝,应在水槽g中加入________。
(4)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分。为除去氯气中的水分,c可以装入下列物质中的________(填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)氯气和白磷反应放出大量的热,为使具支烧瓶d不致因局部过热而炸裂,实验开始前应在烧瓶的底部放少量________。
(6)实验室的白磷保存于水中,取出白磷后用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶,用上述方法可除去水的原因是________________________________________________________。
(7)为防止氯气污染空气,装置末端导出的气体最好用(填字母)________进行净化处理。
A.NaOH溶液 B.Ca(OH)2溶液 C.饱和食盐水
实验室合成氨的装置如图所示。试完成下列问题: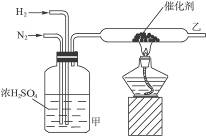
A装置甲的作用是①______________,②______________,③______________;从乙处导出的气体是;检验产物的简单化学方法是___________________________________________。
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净的氮气。反应方程式为
NaNO2+NH4Cl====NaCl+N2↑+2H2O(正反应放热)
如下图所示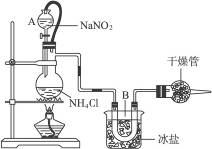
(1)装置中,A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是______________(填写编号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液顺利滴下
(2)B部分的作用是_______________________。
a.冷疑 b.冷却氮气 c.缓冲氮气流
(3)加药品前必须进行的一个操作步骤是____________;加热片刻后即应移去酒精灯以防止反应物冲出,其原因是____________________________。
(4)收集N2前,必须进行的步骤是(用文字说明)__________________;收集N2最适宜的方法是(填写编号)______________。
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中