某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量。采取的主要操作如图,能达到实验目的是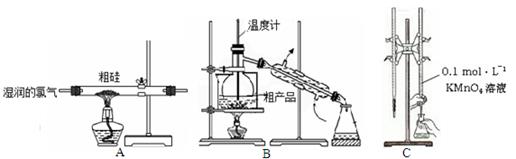
| A.用装置A完成SiCl4的制备 |
| B.用装置B进行蒸馏提纯SiCl4 |
| C.用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 |
| D.配制0.1 mol·L—1 KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
据报导,我国某些城市的酸雨严重,为改变这一状况,某市正准备推广使用的清洁能源,下列所列能源不是清洁能源的是
| A.太阳能 | B.石油 | C.天然气 | D.酒精 |
(1)SiO2属于酸性氧化物,实验室里盛放碱液的玻璃试剂瓶不能用玻璃塞,而常用橡皮塞是因为(用离子方程式表示)。
(2)在实验室中常用苛性钠溶液吸收多余的氯气,防止空气污染,写出反应的离子方程式。
(3)铝制容器不能用于盛放碱性溶液,写出铝与NaOH溶液反应的化学方程式:
;
(4)浓硫酸在实验室可用来干燥N2、HCl等气体,这是利用了浓硫酸的性;常温下可用铁质容器盛装浓硫酸的原因是。
在100mL1mol·L-1 AlCl3溶液中滴加1mol·L-1NaOH溶液,得到3.9g沉淀,则加入的NaOH溶液的体积可能是
| A.160mL | B.200mL |
| C.300mL | D.350mL |
下列有关Na2CO3和NaHCO3性质的比较中,正确的是
| A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3 |
| B.热稳定性Na2CO3<NaHCO3 |
| C.常温时水溶性Na2CO3<NaHCO3 |
| D.相对分子质量Na2CO3<NaHCO3 |
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3 =2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO |
| B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO |
| D.NO>Fe2+>H2SO3>I- |