石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:

(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,写出由气体II中某物质得到水玻璃的化学反应方程式为_________________。
(3)步骤①为:搅拌、过滤,所得溶液IV中的三种阴离子是____________。
(4)由溶液IV生成沉淀V的反应的离子方程式为_____________,100kg初级石墨最多可获得V的质量为___________kg。

(5)使用上面提纯得到的石墨电极电解NO可制得 NH4NO3酸性溶液,其工作原理如下图所示,① 试写出电解池阴极的电极反应式 。② 为使电解产物全部转化为NH4NO3,需补充物质A,A是 ,说明理由: 。
(4分) 同温同压下,同 体积的NH3和H2S气体的质量之比为;同质量的NH3和H2S气体的体积之比为.
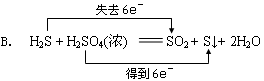
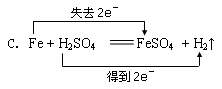
(2分)下列反应中,电子转移方向或数目不正确的是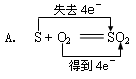

(10分) 有以下几种物质
①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤CO2⑥KNO3溶液⑦氧气,
填空回答(填序号):属于电解质的是;属于非电解质的是;
(6分)写出下列离子的离子符号:
(1)碳酸根离子(2)亚铁离子
(3)铵根离子
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间(S) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。