锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:

已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Zr(OH)4 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀时pH |
1.2 |
2.7 |
3.4 |
6.3 |
| 完全沉淀时pH |
2.4 |
3.2 |
5.2 |
9.7 |
(1)完成高温熔融时的主要反应方程式:ZrSiO4 + 4NaOH = Na2ZrO3 + +
(2)为了提高浸出率可采取的方法有 、 (列举两种)
(3)生成滤渣2的成分 (用化学式表示)
(4)用氨水将滤液2的pH调至 ≤pH< ,目的是 。
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入 气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。负极的电极反应为
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
有一包固体物质,可能含有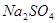 、
、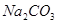 、
、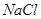 、
、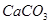 、
、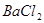 、
、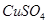 中的一种或几种,现做如下实验。请填空回答其中的问题:
中的一种或几种,现做如下实验。请填空回答其中的问题:
(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液;过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解。由此可知,原固体物质中一定含有,可能含有。
(2)为确定原固体物质中“可能含有”的物质是否存在,现取3.5g原固体,充分溶于水中,将得到的白色沉淀洗涤、烘干后称量,质量为2.33g。通过计算确定:“可能含有”的物质(选填“一定存在”、“一定不存在”或“仍不能确定是否存在”)。
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程。
(2) H2O以键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42-② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是(填序号)。
(4)在下列反应中,水仅做氧化剂的是(填字母,下同),水既不做氧化剂又不做还原剂的是。
| A.Cl2+H2O=HCl+HClO | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(5)已知KH和H2O反应生成H2和KOH,反应中1mol KH(填失去,得到)mol电子
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为。
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|||
| 4 |
⑨ |
⑧ |
⑩ |
(1)①~⑩元素中,金属性最强的是;化学性质最不活泼的是。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是,该化合物与NaOH溶液反应的离子方程式为;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是,碱性最强的是;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是;
用50mL 0.50 mol•L-1盐酸与50mL 0.55 mol•L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: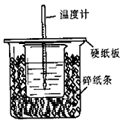
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热△H绝对值。(填偏大、偏小、无影响)