铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:

请回答下列问题:
(1)沉淀B的化学式为 ,溶液C中阴离子主要是 。
(2)操作Ⅰ是 (填操作名称)
(3)写出①过程中发生反应的离子方程式 。
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是 (填操作名称),简述洗涤沉淀的操作方法: 。
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有 (填化学式)。
(6)电解Al2O3制取金属Al的阳极电极反应式为 。
已知 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol  和1mol
和1mol  ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。
(1)比较a______b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
若在原来的容器中,只加入2mol  时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ, 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol 和2mol
和2mol B.4mol
B.4mol 、2mol
、2mol 和2mol
和2mol 
C.4mol 和4mol
和4mol D.6mol
D.6mol 和4mol
和4mol
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出 气体 B.适当升高温度
气体 B.适当升高温度
C.增大 的浓度D.选择高效的催化剂
的浓度D.选择高效的催化剂
硫一碘循环分解水制氢的主要反应如下:
(1)上述循环反应的总反应可以表示为____________________;反应过程中起催化作用的物质是__________(选填编号)。
a. b.
b. c.
c. d.HI
d.HI
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II, 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
(3)对反应II,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下_________也是原来的2倍(选填编号),
a.平衡常数 b.HI的平衡浓度
c.达到平衡时间 d.平衡时 的体积分数
的体积分数
(4)实验室用锌和稀硫酸反应制取 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生 的速率将增大。
的速率将增大。
a. b.
b. c.
c. d.
d.
以氯化钾和硫酸亚铁原料生产硫酸钾和氧化铁红颜料,其主要流程如下:
已知: 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中 大量分解。
大量分解。
(1)写出 溶液中的物料守恒___________________________________
溶液中的物料守恒___________________________________
(2)写出沉淀池I中反应的化学方程式_______________________,该反应必须控制的反应条件是___________________________。
(3)检验沉淀I中 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。
(4)酸化的目的是___________________________。
(5)在沉淀池II中,为使 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
(6)N、P、K、S都是植物生长所需的重要元素。滤液A可做复合肥料,因为其中含有___________等元素。
(7)中国海洋大学应用化学研究所在乙醇燃料电池技术方面获得突破,组装出了自呼吸电池及主动式电堆。乙醇燃料电池的工作原理如图怕示。
①该电池工作时,c口通入的物质为___________。
②该电池负极的电极反应式为_____________________________________。
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: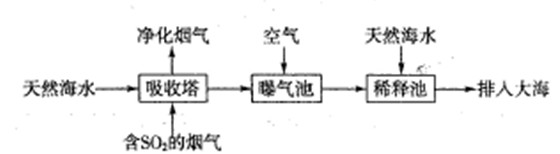
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
分碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s)△H="-l59.5" kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H="+116.5" kJ·mol-1
③H2O(1)=H2O(g)△H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为;每消耗3.4g NH3转移的电子数为(阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)△H="Q" kJ·mol-1。
N2(g)+CO2(g)△H="Q" kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。