有A、B、C三种有机物,结构简式如下图所示,试回答有关问题:
(1)A与C的关系为 。
(2)A→B的反应类型为 。
(3)B→C的化学方程式为 。
(4)1mol A与足量H2发生反应,最多消耗 mol H2;A经加聚反应所得聚合物的结构简式为 。
在一定条件下,某些不饱和烃分子可以进行自身加成反应,例如:
有机物甲的结构简式为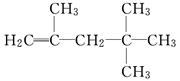 ,它是由不饱和烃乙的两个分
,它是由不饱和烃乙的两个分
子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是_____________________________________________________,
丙的结构简式是______________________________________________________.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液退色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去杂质,再与溴水反应.
(1)写出甲同学实验中两个主要的化学方程式:_____________________________
________________________________________________________________________.
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,理由
是________.
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙炔
d.使溴水褪色的物质就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是________,在验证过程中必须全部
除去,它与溴水反应的化学方程式是______________________________________.
设计方案以电石(CaC2)、H2、Cl2、蒸馏水为原料,合成聚氯乙烯塑料,写出涉及反应的化学方程式.
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
右图中的实验装置可用于制取乙炔.
请填空:
(1)图中,A管的作用是________________________________
____________________________________________________,
制取乙炔的化学方程式是_______________________________
________________________________________________________________________.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是______________________________,乙炔发生了________反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是______________________________,乙炔发生了________反应.
(4)为了安全,点燃乙炔前应______________________,乙炔燃烧时的实验现象是________________________________________________________________________.
将太阳能有效地转化为电能是化石燃料耗尽后解决世界能源问题的关键.有人提出以降冰片二烯为介质将太阳能转换为电能的方法:首先让降冰片二烯吸收太阳光转化为其同分异构体四环烷,而后四环烷在催化剂的作用下重新转化为降冰片二烯并放出热量,生成的降冰片二烯循环使用.
(1)降冰片二烯的键线式是 ,其分子式为________.
,其分子式为________.
(2)写出降冰片二烯与H2发生加成反应的化学方程式:________________________________________________________________________.