某次实验需用0.4 mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯 次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面_____________时,改用___________加蒸馏水至 盖好瓶塞,上下颠倒.混合均匀.
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| B.配制溶液所用的容量瓶洗净后没有烘干 |
| C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
| D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
E .最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F. 定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
某铝合金(硬铝)中含有铝、镁、铜等,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)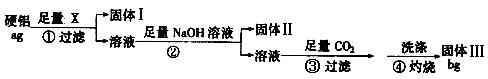
(1)若固体Ⅰ中含有铜,步骤①的试剂X应选择(填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是,得到固体Ⅱ反应的离子方程式为
(2)固体Ⅲ的化学式为步骤④反应的化学方程式为
(3)该铝合金中铝的质量分数是________________
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果(填“偏高”“偏低”“不影响”)
A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:①A与B反应有气体生成 ②B与C反应有沉淀生成 ③C与D反应有沉淀生成 ④D与E反应有沉淀生成 ⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
⑴在②和③的反应中,生成的沉淀物质的化学式(分子式)是__________。
⑵A是________,B是_______,C是_______,D是_______,E是________。
⑶A与E反应的离子方程式是____________________________________________。
A、B、C、D是四种常见单质,其对应元素的核电荷数依次增大,其中B、D属于常见金属,E、F、G化合物。所有物质之间有如下的转化关系:


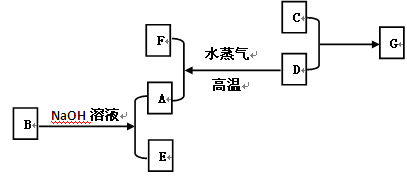
(1)写出D→A+F的化学方程式:;
(2)写出B→A+E的离子方程式:。
(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是___________________;
(4)向含0.1 mol E的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g,则加入盐酸体积为mL。
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图: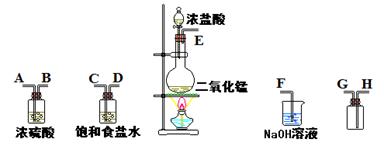
(1)连接上述仪器的正确顺序(填各接口处的字母):接;接;
接;接。
(2)装置中,饱和食盐水的作用是;NaOH溶液的作用是。
(3)化学实验中常用湿润的淀粉—KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到,反应方程式。
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
②NaOH溶液中发生的反应:
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为;
③当有0.2mole-转移时被氧化的HCl的质量是;该反应中被氧化和未被氧化的盐酸的物质的量之比是,
④如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将。
| A.≥1.68L | B.>1.68L | C.≤1.68L | D.<1.68L |
有关FeSO4的转化关系如下图所示(无关物质已略去)。
已知:① X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
② Y是红棕色的化合物。
(1)气体X的成分是(填化学式)。
(2)反应I的反应类型属于(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是。