已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O
D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,
D的单质与水反应的方程式为_ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)气态SeO3分子的立体构型为________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为 ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为___________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的
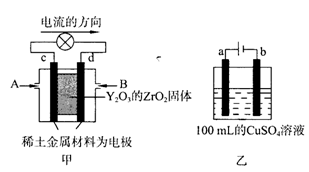
①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
(1)某可逆反应在不同条件下的反应历程分别为 、
、 ,如图所示。
,如图所示。
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中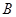 历程表明此反应采用的条件为 (选填序号)。
历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)1000℃时,硫酸钠与氢气发生下列反应: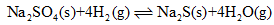
该反应的平衡常数表达式为 。
已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)
(3)生铁在潮湿空气中会发生吸氧腐蚀。
①电解质溶液可选用(填序号) 。
A.NaOH溶液 B.C2H5OH C.NaCl溶液 D.稀硫酸
②写出生铁在潮湿空气中吸氧腐蚀正极的电极反应式 。
(1)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛地开发和应用前景。反应:
① 下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1__________0(选填“>”“=”或“<”),根据该反应特点,此反应自发进行的条件是____________(选填“高温”“低温”或“任何温度”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___________。
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度见下表。
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/mol·L-1 |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正__________v逆(选填“>”“<”或“=”)
②若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol·L-1,则该时间内反应速率v(CH3OH)=_____________。
(3)已知:
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38;当溶液的pH=4时,则此溶液中Fe3+的物质的量浓度是_____________。