“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是______________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原
反应,下列反应可能发生的是______________。
A.NH4NO3 → N2 + O2 + H2O B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O,推测X的化学式为______________。
② NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,方程式中e : f的值为______________(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:
________________________________________________________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
某无色溶液X,K+、Ba2+、Al3+、Fe3+、[Al(OH)4]-、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验: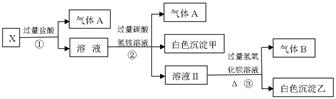
(1)气体A的成分是(填化学式,下同),气体B的成分是。
(2)写出步骤①中产生气体的离子方程式。
(3)分别写出形成白色沉淀甲和气体B的离子方程式
;。
(4)通过上述实验,可确定X溶液中一定存在的离子是,
尚未确定是否存在的离子是,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是。
按要求写出有水参与的氧化还原反应的化学方程式
(1)水是氧化剂:
(2)水是还原剂:
(3)水既不是氧化剂也不是还原剂:
(4)水既是氧化剂也是还原剂:
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内,配平后标出电子转移的方向和数目。
(2)反应中,被还原的元素是,还原剂是。
(3)纺织工业中常用氯气作漂白剂 ,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为。
,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为。
标准状况下,向100mLNaOH溶液中慢慢通入CO2气体充分反应后,在所得溶液M中逐滴加入1mol/L盐酸,(反应前后溶液体积变化忽略不计)所得气体体积和所加盐酸的体积关系如图。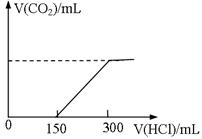
(1)c(NaOH)=
(2)取M溶液40mL与等体积的1mol/L盐酸按各种可能方式混合,产生气体的体积为VmL,则V的取值范围为。
A、B、C是常见短周期元素的单质,常温下D为无色液体 ,E是一种常见的
,E是一种常见的
温室气体。其转化关系如图所示(反应条件和部分产物略去)。试回答: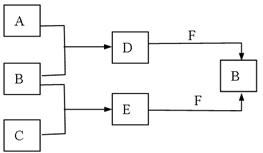
(1)F的电子式为;
(2)少量的金属单质铝与D和F混合,写出反应的离子方程式。
(3)D2mol、E 2mol与3molF在密闭容器中充分反应,所得固体成分为;其相应的物质的量为。