下列实验设计和结论相符的是
| A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的蓝色石蕊试纸变红,该气体水溶液一定显酸性 |
| C.某无色溶液中加硝酸钡溶液,再加入盐酸,沉淀不溶解,则溶液中一定有SO42— |
| D.某无色溶液中加盐酸,产生无色气体,溶液中一定有CO32— |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
| A.Na+、SO42-、C6H5O-、Cl- | B.Na+、CO32-、NO3-、Br- |
| C.Al3+、Cl-、SO42-、I- | D.K+、AlO2-、NO3-、SO42- |
向15mL 0.1mol/L Ba(OH)2溶液中,滴加等浓度NH4Al(SO4)2溶液x mL,下列叙述错误的是
| A.x=5时,溶液中有Ba2+、OH-、AlO2-,且OH-> AlO2- |
| B.x=7.5时,溶液中有NH4+、AlO2-,且NH4+=AlO2- |
| C.x=10时,溶液中有SO42-、NH4+,且H+> OH- |
| D.x=15时,溶液中有SO42-、NH4+、Al3+,且NH4+> Al3+ |
下列实验,所选装置不合理的是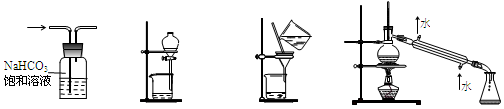
①②③④
| A.除去CO2中的HCl,选① |
| B.分离碘的CCl4溶液和水,选② |
| C.除去乙醇中的苯酚,选③ |
| D.分离CCl4(沸点76.8℃)和正丁醇(沸点117.2℃),选④ |
下列对检验方法或现象描述错误的是
| A.苯中是否混有苯酚,可用加溴水是否产生白色沉淀进行检验 |
| B.乙醛中是否混有乙醇,可用加入金属钠是否产生气体进行检验 |
| C.乙醇中是否混有水,可用加硫酸铜粉末是否变蓝进行检验 |
| D.乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检验 |
浓硫酸的性质有:①酸性、②强氧化性、③脱水性、④难挥发性等。乙醇、溴化钠和浓硫酸混合共热制备溴乙烷时,会有多个副反应发生,此过程中浓硫酸显示的性质是
| A.①②③④ | B.①和② | C.只有① | D.①和④ |