Ⅰ.硼元素B在化学中有很重要的地位。硼的化合物在农业、医药、玻璃工业等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布简式 。从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同数原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是 。又知若有d轨道参与杂化,能大大提高中心原子成键能力,试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-,后者却是生成SiF62-: 。
Ⅱ.图所示为血红蛋白和肌红蛋白的活性部分---血红素的结构:
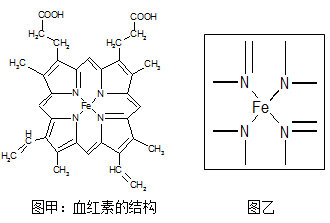
回答下列问题:
(1)根据元素电负性请判断H2N-CHO中碳和氮的化合价分别为 和 。
(2)血红素中两种氮原子的杂化方式分别为 , ;在图乙的方框内用“→”标出亚铁离子的配位键。
A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出,根据不同信息分别完成(1)(2)两个小题。
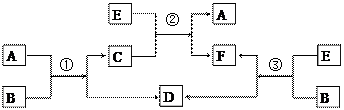 |
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为 (填写相应的字母),其中A的化学式是 。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应①的化学方程式是 。在反应③中,若生成1 mol D,则转移电子的数目为 。
按下面的实验过程填空: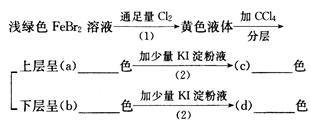
写出上述反应的化学方程式:
(1)_________________________________________________________
(2)_________________________________________________________
(3)_________________________________________________________
某NaBr、NaI混合液中,含NaBr 0.1mol,NaI 0.2mol。通入vL(标准状况)氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质。
当v的取值范围为0<v<2.24L时,固体剩余物质成分是;
当固体剩余物质成分是NaCl时,v的取值范围为;
当固体剩余物质成分是NaCl和NaBr时,v的取值范围为。
针对以下①~④四个涉及H2O2的反应(未配平),填写空白:
①Na2O2+HCl——H2O2+NaCl
②Ag2O+H2O2——Ag+O2↑+H2O
③H2O2——H2O+O2↑
④H2O2+Cr2(SO4)3+KOH——K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的是 (填代号,下同),该反应配平的方程式为 。
(2)H2O2既体现氧化性又体现还原性的是 。
(3)H2O2仅体现弱酸性的反应是,其理由为 。
常温下,将Fe粉和S粉混合,不发生反应。某课外活动小组将Fe粉和S粉按物质的量比1∶1混合均匀,并置于水平放置且隔绝空气的玻璃管中,加热片刻,反应开始,然后撤去酒精灯,发现反应仍能剧烈进行,并使生成的固体呈红热状态。试完成下列问题:
(1)上述现象说明了_____________________________。
(2)将生成的黑色固体置于稀H2SO4中,有气体放出,写出发生反应的离子方程式__________________________________________________________。
(3)已知H2S是一种剧毒、有刺激性气味的气体,试说明实验室制取H2S时应采用的一条安全措施___________________________。
(4)将21.0 g铁粉(过量)和硫粉混合,在隔绝空气情况下加热,将反应后的全部物质装入到足量的稀盐酸中,则生成气体的体积为____________(标准状况)。