I. H2A在水中存在以下平衡:H2A  H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________。
| A.c(Na+ )>c(K+ ) | B.c(H +)•c(OH )=1×10-14 |
| C.c(Na+ )=c(K+ ) | D.c(Na+ )+c(K+ )=c(HA- )+c(A2-) |
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:

(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为: 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+的浓度为_________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):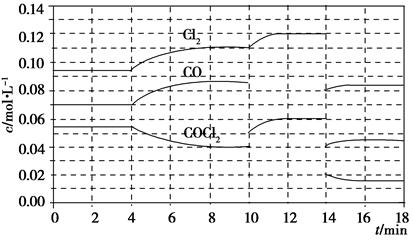
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
已知CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
| t/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
E.混合气体的密度不变
(3)在850 ℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向进行的有________(选填A、B、C、D、E)。
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)在850 ℃时,可逆反应:CO2(g)+H2(g) CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间 /min |
CO2 (mol·L-1) |
H2 (mol·L-1) |
CO (mol·L-1) |
H2O (mol·L-1) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
则3 min~4 min平衡后c3=________mol·L-1,CO2的转化率为________。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l)
ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)
ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题: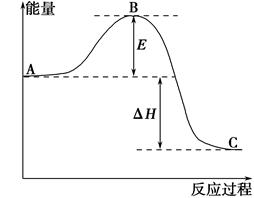
(1)图中A、C分别表示________、________;
(2)E表示________;E的大小对该反应的反应热________(填“有”或“无”)影响。
(3)该反应通常用V2O5作催化剂,加V2O5会使图ΔH________(填“变大”、“变小”或“不变”),理由是_____________________________________。
(4)图中ΔH=________kJ·mol-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________(要求计算过程)。
部分中学化学常见元素原子结构及性质如表所示:
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② |
B |
B原子最外层电子数是内层电子总数的 |
| ③ |
C |
C是常见化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ |
F |
F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是_______________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱__________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_______________________________________________________________。