已知:25℃时, Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24.下列叙述正确的是
| A.25℃时,FeS、ZnS、CuS的溶解度依次增大 |
| B.ZnS饱和溶液这加入少量Na2S固体,平衡后溶液中c(Zn2+)·c(S2-)=Ksp,c(Zn2+)=c(S2-) |
| C.除去工业废水中的Cu2+,可用FeS作为沉淀剂 |
| D.某溶液中含有Fe2+、Cu2+和Zn2+,浓度均为0.010mol/L。向该溶液中逐滴加入0.010mol/L的Na2S溶液时,Fe2+最先沉淀出来 |
油脂皂化后,使肥皂和甘油从混合物里充分分离,应加入的试剂是( )
| A.盐酸 | B.食盐 | C.水 | D.氢氧化钠 |
下列各组物质中既不是同系物又不是同分异构体的是()
| A.软脂酸甘油酯与硬脂酸甘油酯 | B.甲酸甲酯和乙酸 |
| C.对甲基苯酚和苯甲醇 | D.油酸甘油酯和乙酸甘油酯 |
下列反应既是加成反应又可看作还原反应的是()
| A.乙烯水化 | B.油脂氢化 |
| C.乙醛转化为乙醇 | D.乙醛转化为乙酸 |
分析某油脂水解所得的高级脂肪酸时,只测定出两种不饱和脂肪酸,已知原油脂的碘值为116 g(碘值是指与100 g油脂加成时消耗碘的克数)。则此油脂的结构是()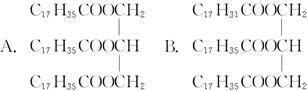
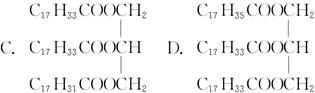
下列说法不正确的是()
| A.植物油可作溴水中提取溴的萃取剂 | B.硬水会使肥皂去污能力降低 |
| C.人造脂肪和生产盐酸都必须用H2作原料 | D.甘油可以用作防冻剂 |