现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(已知Al(OH)3具有两性,既可与强酸反应,又可与强碱反应Al(OH)3+NaOH=Na[Al(OH)4]、CO32-与Al3+或Fe3+在水溶液中不能共存,会相互反应产生相应氢氧化物沉淀及CO2气体等)
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_________和_________(填化学式,且相对分子质量最小的写在第一个空);
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质为记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解.则:X为_________;
A.SO3- B.SO42- C.CH3COO- D.SiO32-
(3)向B的水溶液中逐滴加入盐酸且边加边振荡,发现基本没有气泡,原因是____________(用离子方程式表示);
(4)将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为______(保留两位小数)。
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.则物质D一定含有上述离子中的_________(填相应的离子符号).有关反应的离子方程式为_________;
(6)利用上述已经确定的物质,可以检验出D中的阳离子.请简述实验操作步骤、现象及结论_________;
Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu(s) ===Cu2+(aq) +2Ag(s)设计原电池,请回答下列问题:
(1)负极材料是____________;电解质溶液是____________;
(2)正极发生的电极反应为________________________;
(3)电解质溶液中Ag+向_________极移动。
Ⅱ.一定温度下在某定容容器中发生反应:2A(g) +3B(g) ===2C(g),开始时,A的浓度为2 mol·L -1,B的浓度是4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
(1)v(B) =___________,v(C) =____________。
(2)在2min末,C的浓度是____________,B的浓度是____________。
A、B、C三种元素的原子具有相同的电子层数,且都是短周期元素。已知A是一种金属元素,A原子的最外层电子数为1,它跟酸反应后转化成的A+具有跟Ne相同的电子层结构。B的质子数比A多2个,C的质子数比B多4个。根据以上条件,填空回答:
(1)C是元素(写元素名称),画出C原子结构示意图:。
(2)B元素在周期表中的位置是第周期,第族。
(3)C元素的气态氢化物的水溶液呈(填“酸性”、“碱性”、“中性”)。
(4)A与C形成的化合物的电子式:。
(5)B元素的最高价氧化物对应的水化物与C元素的气态氢化物的水溶液之间发生的化学反应方程式:。
Ⅰ.现有6种有机物:①乙烯 ②苯 ③乙醇 ④乙醛 ⑤乙酸 ⑥乙酸乙酯。按下列要求填写下列空格(填写序号):
(1)具有酸的通性的是;
(2)在一定条件下,能发生银镜反应的是;
(3)在一定条件下,既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,还能发生加聚反应的是;
(4)在一定条件下,既可发生加成反应,又可发生取代反应的烃是;
(5)在一定条件下,能发生水解反应的是。
Ⅱ.A是石油化工的原料,D是食醋的主要成分,E是具有果香味的液体。在一定条件下,它们的衍变关系如下:
(1)试写出A、B、C的结构简式:
A,B,C。
(2)写出B→C的化学反应方程式:。
一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:

则该反应的△H0(选填“>” 或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ.mol-1
CO2(g)+C(s)=2CO(g) △H2=+172.5kJ.mol-1
S(s)+O2(g)=SO2(g) △H3=-296.0kJ.mol-1
请写出CO除SO2的热化学方程式。 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为,H2的平均生成速率为。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为,H2的平均生成速率为。
(4)下图中图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。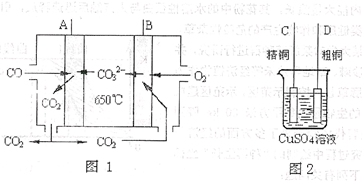
回答下列问题:
①写出A极发生的电极反应式。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为。
I.由C、H、O三种元素组成的有机物R,R的相对分子质量122,其中含碳元素的质量分数为68.9%,含氧元素的质量分数为26.2%。R与NaHCO3溶液反应,生成的气体能使澄清石灰水变浑浊。则R的分子式是____________________。
II.M是生产某新型塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键等)。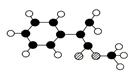
拟从芳香烃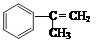 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
已知:M在酸性条件下水解生成有机物F和甲醇。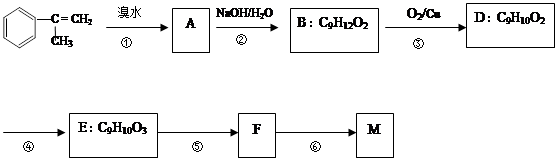
(1)M的结构简式。
(2)写出②、⑤反应类型分别为、。
(3)D中含氧官能团的名称为,E的结构简式。(4)写出反应⑥的化学方程式(注明必要的条件):
。
(5)写出符合下列两个条件的结构简式:①与F互为同分异构体;②能发生水解反应,水解产物有两种,一种能使溴的四氯化碳溶液褪色,另一种滴加FeCl3溶液显紫色。。