工业制硝酸的主要反应为:
4NH3 (g) +5O2 (g)  4NO(g) + 6H2O(l) △H
4NO(g) + 6H2O(l) △H
(1)已知氢气的燃烧热为△H =﹣285.8kJ/mol。
N2(g)+3H2(g)═ 2NH3(g) △H =﹣92.4kJ/mol;
N2(g)+ O2(g)═ 2NO(g) △H = +180.6kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 浓度 |
c(NH3)(mol/L) |
c(O2)(mol/L) |
c(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min[ |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.7 |
1.475 |
0.1 |
①反应在第2min到第4min时,O2的平均反应速率为 。
②反应在第6min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g) + 6H2O(g)达到平衡状态的是 (填序号)。
4NO(g) + 6H2O(g)达到平衡状态的是 (填序号)。
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O) = 4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
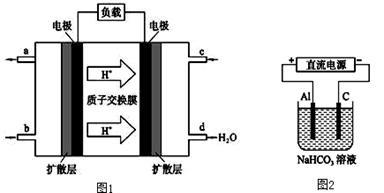
(3)某研究所组装的CH2 =CH2﹣O2燃料电池的工作原理如图1所示。
①该电池工作时,b口通入的物质为 。
②该电池负极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是: (用相关的离子方程式表示)。
(8分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为。 (2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式。 FB2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为__________________________。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式。 FB2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为__________________________。
(3)均由A、D、E、F四种元素组成的两种盐,其相对 分子质量相差16,写出它们在溶液中相互作用的离子方程式为______
分子质量相差16,写出它们在溶液中相互作用的离子方程式为______ _________________________
_________________________ ___________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)____________________________________________________________________。
___________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)____________________________________________________________________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时,负极的电极反应式为__________________________________.。
在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4)(mol) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2)(mol) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为。
(2)在80℃时该反应的平衡常数K=。
(3)要增大该反应的平衡常数,可采取的措施有(填序号)。
①增大N2O4的起始浓度②向混合气体中通入NO2
③使用高效催化剂④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色(填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平 衡后N2O4的转化率将(填“增大”、“减小”或“不变”)。
衡后N2O4的转化率将(填“增大”、“减小”或“不变”)。
下图表示一个电解 池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
(1)X电极上的电极反应式为,
在X极附近观察到的现象是。
(2)Y电极上的电极反应式为,
若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为g 。
(1)已知天然气和水蒸气反应的热化学方程式为:CH4(g) + H2O(g)  CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为kJ;
CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为kJ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =kJ·mol-1。
CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =kJ·mol-1。
写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3