(1)已知天然气和水蒸气反应的热化学方程式为:CH4(g) + H2O(g)  CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为 kJ;
CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为 kJ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH = kJ·mol-1。
CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH = kJ·mol-1。
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g)CO2(g)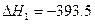 kJ·mol-1
kJ·mol-1
C(a)+H2O(g)CO(g)+H2(g)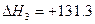 kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g)H2O(g)+CO2(g)的 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) 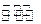 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(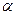 )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K=。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为(填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为。
③实验过程中,氨水中的溶2O的电子离程度先后(填“增大”、“减小”或“不变”)。
测定慕硫酸锄黑体(Na2SO4·XH2O)中结晶水含量韵实验包括如下两步:
①将硫酸钠晶体制成粉末,准确称取该样品26.8 g
②将样品加热至恒重,冷却后称得样品质量变为14.2 g
试回答下列问题:
(1)将晶体制成粉末,所用的主要化学仪器是____(填仪器名称,下同);准确称量后将样品放在中加热至恒重。
(2)判断试样已加热至恒重的标准是________。
(3)根据实验数据计算出x=____。
(4)下面的情况有可能造成测定结果偏低的是(填序号)。
| A.试样中含有加热易挥发的杂质 | B.加热后不是在于燥器中冷却试样 |
| C.实验前坩埚来完全干燥 | D.加热时有晶体溅出 |
E.试样中含有加热不挥发的杂质
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是(填编号,下同),溶液中溶质存在电离平衡的是。
(2)四种溶液中对水的电离抑制作用最大的是;比较①、②溶液,pH较大的是。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH
 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。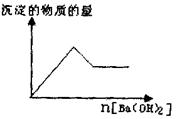
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定 存在的离子有;
存在的离子有;
肯定不存在的离子有____。
I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+KIO3+H2SO4——Na2SO4+K2SO4+ I2+H2O
①配平上面的氧化还原反应方程式,将计量数填在方框内。
②其中氧化剂是,若反应中有5 mol电子转移,则生成的碘是mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为。
II.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是。
(2)CNO-经进一步处理后产生的两种无毒气体应该是和。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为。
短周期元素A、B、C、D、E原子序数依次增大,其中D是日常生活中常见的金属元素,E是所在周期原子半径最小的主族元素,A、B、C分别位于不同周期,且A和C同主族。回答下列问题:
(1)B和A组成的简单化合物与B元素最高价的含氧酸反应生成一种盐,则B和A组成的简单化合物的化学式为,其空间构型为型,属于(填“极性”或“非极性”)分子。
(2)D原子结构示意图为,C的晟高价氧化物对应水化物与D的最高价氧化物 对应水化物反
对应水化物反 应的离子方程式为。
应的离子方程式为。
(3)在B和A组成的简单化台物与BE3这两种物质中B元素的化合价相同,其中BE3 可与水发生水解反应,其中会生成一种强氧化性物质,则反应方程式为,该强氧化性物质的结构式为。
可与水发生水解反应,其中会生成一种强氧化性物质,则反应方程式为,该强氧化性物质的结构式为。