中科院大连化学物理研究所的“煤基甲醇制取低碳烯烃技术(简称DMTO)”荣获2014年度国家技术发明一等奖。DMTO技术主要包括煤的气化、液化、烯烃化三个阶段,相关反应的热化学方程式如下:
(i)煤气化制合成气:C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
(ii)煤液化制甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(iii)甲醇制取低碳烯烃:2CH3OH(g) C2H4(g)+2H2O(g) ΔH= -11.72kJ·mol-1……(a)
C2H4(g)+2H2O(g) ΔH= -11.72kJ·mol-1……(a)
3CH3OH(g) C3H6(g)+3H2O(g) ΔH= -30.98kJ·mol-1……(b)
C3H6(g)+3H2O(g) ΔH= -30.98kJ·mol-1……(b)
回答下列问题:
(1)已知:C(s)+CO2(g)=2CO(g) ΔH= +172.5kJ·mol-1,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= -41.0kJ·mol-1
反应(i)能自发进行的条件是 (填“高温”、“低温”或“任何温度”)。
(2)反应(ii)中以氢碳[n(H2)∶n(CO)]投料比为2制取甲醇,温度、压强与CO的平衡转化率关系如下图1。



①对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则A点时反应(ii)的Kp= (保留两位有效数字,分压=总压×物质的量分数)。
②比较P1 P2,Kp(Q) Kp(R)(填“大于”、“小于”或“等于”)。
③工业上常以铜基催化剂,压强5MPa,温度275℃下发生反应(ii),CO转化率可达到40%左右。为提高CO转化率除了可以适当改变反应温度和压强外,还可以采取的措施有 (写出2个)。
④若反应(ii)在恒容密闭容器内进行,T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t2时刻迅速降温到T2,t3时刻体系重新达到平衡。试在图中画出t2时刻后甲醇浓度随时间变化趋势图(在图中标出t3)。
(3)烯烃化阶段:在常压和某催化剂作用下,甲醇的平衡转化率及乙烯、丙烯等物质的选择性(指除了水蒸气以外的产物中乙烯、丙烯等物质的物质的量分数)与反应温度之间的关系如图3。为尽可能多地获得乙烯,控制反应温度为550℃的理由是 。
(选考)某磷肥厂利用某磷矿石[Ca3(PO4)2]制取磷肥并综合利用副产物生产水泥的工艺流程如下: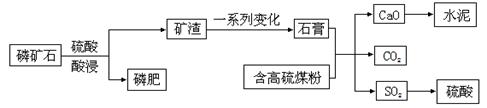
(1)将磷矿石制成磷肥的目的是,有关的化学方程式为。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是。
(3)水泥属于材料。
(填“A”或者“B”:A.新型无机非金属材料 B.传统无机非金属材料)
(4)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则该热化学方程式为,平衡常数K为。
(5)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。若98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,则a=,b=。
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡移动(填“向左”、“向右”或“不”),溶液中 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为:。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为;P1P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=。
(15分)某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如下: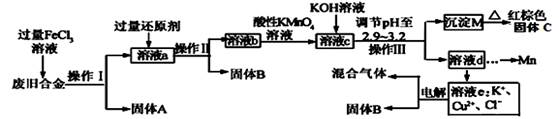
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是。
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是,溶液a中发生的反应的离子方程式为。
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至。
(6)工业上由红棕色固体C制取相应单质常用的方法是。
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为。
【化学—选修3:物质结构与性质】(15分)A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,C的氢化物水溶液呈碱性;D的基态原子3p轨道上有3个未成对电子;E、F为副族元素,4s能级均只有一个电子。回答下列问题:
(1)A、B、C三种元素按电负性由小到大的顺序是_________(用元素符号表示)。
(2)B与氧原子能形成四原子阴离子,其中B的杂化方式为_____________;C的三氯化物分子的立体构型为____________________________________。
(3)任写一种与BC—离子互为等电子体的离子__________________(写出化学式)。
(4)F原子的外围电子排布式为_____________,F晶体中原子的堆积方式是下图中的_________(填写“甲”、“乙”或“丙”)。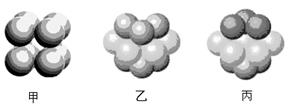
(5)E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体。该晶体中E3+、Cl—、H2O的物质的量之比为1∶3∶6,且E的配位数为6。向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g白色沉淀,则该配合物的化学式为__________________________。
(6)AD是一种耐磨材料,其结构与金刚石相似,下图为其晶体结构单元,它可由A的三溴化物和D的三溴化物于高温下在氢气的氛围中合成。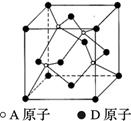
①写出合成AD的化学方程式:________________________。
②已知晶体中A与D原子的最近距离为a pm,则该晶体密度的表达式为_________g/cm3。(不需化简,阿伏加德罗常数为NA)
【化学选修2:化学与技术】海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%。
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如下图所示,电渗析法淡化海水时阴极室可获得的重要化工原料有。
| 时间 |
4℃ |
10℃ |
20℃ |
35℃ |
55℃ |
90℃ |
| 5分钟 |
0 |
0.2 |
0.4 |
0.7 |
0 |
0 |
| 10分钟 |
0 |
1.0 |
1.3 |
1.2 |
0.1 |
0 |
| 15分钟 |
0.1 |
1.9 |
2.2 |
2.8 |
0.2 |
0 |

(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法。盐田分为贮水池、池和结晶池,建盐田必须在处建立(填写序号)。
A.选在离江河入海口比较近的地方
B.多风少雨
C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制。第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下: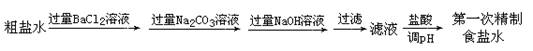
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 |
CaCO3 |
BaSO4 |
BaCO3 |
| 2.6×10-2 |
7.8×10-4 |
2.4×10-4 |
1.7×10-3 |
①检测Fe3+是否除尽的方法是__________________________________________。
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因_______________。
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式__________。
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。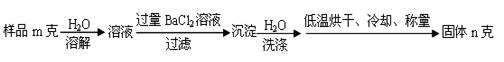
①检验沉淀是否洗涤干净的方法是________________________________;
②样品中NaCl质量分数的数学表达式为_____________________。