制造导弹的雷达罩和宇航员使用的氧气瓶的主要材料是透明聚酯玻璃钢,制备它的一种配方中含有下列四种物质:



(甲) (乙) (丙) (丁)
填写下列空白:
(1)甲中不含氧原子的官能团是______;甲分子_____(填“有”或“无”)顺反异构现象;下列试剂能与甲反应而褪色的是(填标号) 。
a. Br2/CCl4溶液 b. 石蕊溶液 c.酸性KMnO4溶液
(2)写出乙与足量Na反应的化学方程式 。
(3)已知:
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 。
(4)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 。
已知:A酸的溶液pH=a,B碱的溶液pH="b"
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH=。若酸碱按体积比为1:10混合后溶液显中性,
则a+b=。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol·L-1,B溶液中水电离出的氢离子浓度为。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为。
某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子,有关的离子反应式为。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)。
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
下列为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀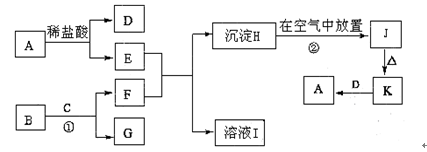
请写出:
(1) A、B的化学式为:A,B。
(2)过程②中的反应现象:。
(3)反应①的化学方程式。
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式。
(2)NO2是一种色的气体,在上述反应中作(填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为。
(3)上述反应中氧化剂与还原剂的物质的量之比为,HNO3在反应中表现出性和性。
(4)若反应中生成1mol的NO2,则反应中转移mol的电子,消耗Cug。
欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去。已知:
 (1)某含铬废水处理的主要流程如图所示:
(1)某含铬废水处理的主要流程如图所示:
①沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,用离子方程式表示其反应原理
。
②反应池中发生主要反应的离子方程式是Cr2O2—7+3HSO—3+5H+===2Cr3++3SO2—4+H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是、。证明Cr3+沉淀完全的方法是。
(2)工业亦可用电解法来处理含Cr2O2-7废水。实验室 利用如图模
利用如图模 拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+
拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+ ,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3
,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3 +,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:。
+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:。
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是g。