阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
| 醋酸 |
102 |
139.4(沸点) |
反应 |
| 乙酸水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是_____________________;
(2)写出制备阿司匹林的化学方程式_____________________;
(3)①合成阿斯匹林时,最合适的加热方法是____________;
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是_____________________;
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是_____________________;另一种改进的提纯方法,称为重结晶提纯法.方法如下:
(5)改进的提纯方法中加热同流的装置如下图所示,使用温度计的目的是_______________;冷凝水的流进方向是__________(填“b”或“c”)。
(6)检验产品中是否含有水杨酸的试剂是_______________;
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为_______________;
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
(1)实验操作③的名称是___________,所用主要仪器名称为______________________。
(2)提取碘的过程中,可选择的试剂是________________(已知碘的沸点为184.40C)。
A.酒精(沸点780C) B.四氯化碳(沸点770C)
C.甘油(沸点1900C) D.苯(沸点800C)
(3)操作②的离子方程式为;该步骤的含I2溶液中生成有少量ICl,为使碘全部以单质形式游离出来,应加入适量KI溶液,此反应的化学方程式为。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验 编号 |
温度 (℃) |
大理石 规格 |
HNO3浓度(mol/L) |
实验目的 |
| ① |
25 |
粗颗粒 |
2.00 |
(I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究对反应速率的影响 |
| ② |
25 |
粗颗粒 |
||
| ③ |
粗颗粒 |
2.00 |
||
| ④ |
25 |
细颗粒 |
2.00 |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HNO3/*-表示的平均反应速率(忽略溶液体积变化,不需要写出计算过程)。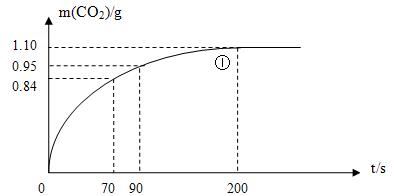
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________________;
__________________________________________。
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是_____________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中氢气生成速率,还可采取的措施有___________________________
____________________________________________________________ (答两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/L H2SO4(mL) |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液(mL) |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O(mL) |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________________________________________________________________________________________________________。
实验室常用下图装置制取氨气:请回答下列问题:
(1)写出图中带有编号的仪器名称a___________ b___________。
(2)写出该实验中制取氨气的化学方程式:________________________________。
(3)检验氨气是否收集满的方法是__________________________________。
(4)不用排水法收集氨气的原因是:_________________________。
(5)试管口棉花的作用是:_________________________________。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 |
实验现象 |
||||
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。 ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器、材料: 略药品: 略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 |
实验现象 |
有关离子方程式 |
| A |
||
| B |
不填 |
|
| C |
不填 |
|
| D |
不填 |
|
| E |
(4)实验结论:____________________________________________________。
(5)请用原子结构理论解释上述结论的原因___________________________