过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
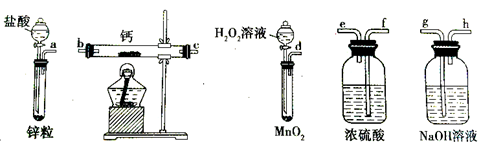
(1)请选择必要的装置,按气流方向连接顺序为 (填仪器接口的字母编号,装置可重 复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后, (填操作);④拆除装置,取出产物。
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2 .8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如下:

①装置A中发生反应的化学方程式为 。
②NH3在Ca2+和H2O2的反应历程中所起的作用是 。
③反应结束后,经 (填操作名称)、洗涤、低温烘干可获得CaO2 .8H2O。
检验CaO2 .8H2O是否洗涤干净的操作为 。
④已知CaO2 在350℃迅速分解生成CaO和O2。若所取产品质量是mg,加热至恒重时,
剩余固体ng,则产品中CaO2 的质量分数为 (用字母表示)。
(4)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂,设计试验检验钙的燃烧 产物中是否含有过氧化钙 。(简要说明实验步骤、现象和结论)
限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸
检验SO2气体中是否存在CO2气体,应采用的方法是()
| A.通过澄清石灰水 |
| B.先通过小苏打(NaHCO3)溶液,再通过石灰水 |
| C.先通过足量酸性高锰酸钾溶液,再通过石灰水 |
| D.通过品红溶液 |
铁不能与冷水反应,但能与水蒸气反应,某化学兴趣小组为探究铁与水蒸气反应,请你为他们完成实验报告。
实验目的:探究铁与水蒸气的反应
反应原理:(用化学反应方程式表示)
实验装置:回答以下问题(加热装置略去)
| 装置编号 |
A |
B |
C |
D |
|
| 装置 |
 |
 |
 |
 |
|
| 装置所起作用 |
|||||
| 按加热先后从左至右,实验装置连接顺序和导管连接方法 |
装置连接顺序:(填装置编号) |
||||
| 需要加热的装置 |
(填装置编号) |
||||
实验装置改进:兴趣小组同学根据反应原理改进实验装置,得到相同的结论,如图所示:
问:试管底部是蘸有水的湿棉花,其作用是,蒸发皿内加入的肥皂液的作用。
(10分) 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究。
(1)提出假设
①气体产物是CO2。②气体产物是CO。③气体产物是。
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、0.48g碳粉混合均匀,放入50.00g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为。
(5)数据处理
试根据实验数据分析判断,前面的假设_________(填①、②、③)是正确的。写出该实验中氧化铁与碳发生反应的化学方程式:。
.(16分)某课外活动小组同学用下图装置进行实验,试回答下列问题。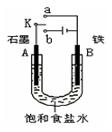
(1)若开始时开关K与a连接,则B极的电极反应式为。
(2)若开始时开关K与b连接,则B极的电极反应式为,总反应的离子方程式为,有关该实验的下列说法正确的是(填序号)。
①溶液中Na+向A极移动②从A极处逸出的气体能使湿润KI淀粉试纸变蓝③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。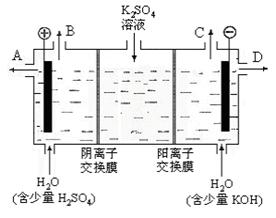
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为。
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: NaBr+H2SO4 HBr+NaHSO4① R-OH+HBr
HBr+NaHSO4① R-OH+HBr R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
|
| 密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
| 沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性(填“大于”、“等于”或“小于”)相应的醇;其原因是。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaIb.NaOH c.NaHSO3 d. KCl