从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是:
①地壳中的金属元素的含量;②金属活动性顺序;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性;
| A.①③ | B.②⑤ | C.③⑤ | D.②④ |
在一密闭容器中进行下列反应:2SO2(g)+O2(g)  2SO3(g).已知反应过程中某一时刻SO2,O2,SO3的浓度(mol/L)分别为:0.2, 0.1, 0.2. 当该反应达到平衡时可能存在的数据是
2SO3(g).已知反应过程中某一时刻SO2,O2,SO3的浓度(mol/L)分别为:0.2, 0.1, 0.2. 当该反应达到平衡时可能存在的数据是
| A.SO2为0.4mol/L,O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.4mol/L |
在一定条件下将1mol的CO和1mol H2O(g)放入密闭容器中发生反应:CO(g)+H2O(g) 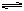 CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
| A.小于0.6mol大于0.4mol | B.等于1mol |
| C.大于0.6mol,小于1mol | D.大于1mol |
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)  H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
| A.HI的分解速率小于其生成速率 | B.HI的分解速率等于其生成速率 |
| C.HI的分解速率大于其生成速率 | D.无法判断 |
在2A(g) + B(g) 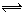 3C(g) +4D(g)反应中,表示该反应速率最快的是 ( )
3C(g) +4D(g)反应中,表示该反应速率最快的是 ( )
A. V(A)==0.5mol/(L·S) B.V(B)="=0.3mol/(L·S)"
C .V(C)==0.8mol(L·S) D.V(D)==1mol/(L·S)
把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应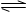 3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为()
3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为()
A.1 B.2 C.3 D.4