某课外活动小组用如图装置进行实验,试回答下列问题。
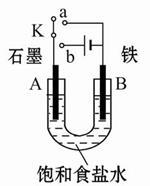
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述(2)实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
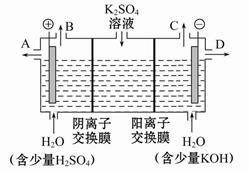
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答: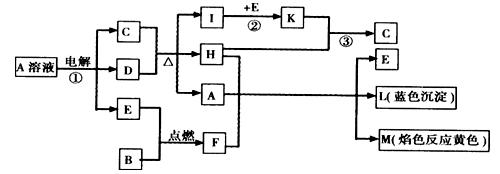
(1)写出化学式:A____________;E______________;L_______________。
(2)反应①的离子方程式:__________________________________________________。
(3)反应②,工业上采取的反应条件是________________________________。
(4)反应③,工业上采取的操作不是K直接与H反应,原因是_______________
____________________________________________________。
(5)每生成1 mol K,反应放出98.3 kJ热量,该反应的热化学方程式为:
______________________________________________________________________。
某化学课 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有__________________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
A.施用该物质会大大提高粮食产量而对环境无影响
B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH4+ + OH– = NH3•H2O
C.可通过加热方法区别该试剂和(NH4)2SO4
D.工业上用NH3等合成该物质的过程可称为氮的固定
(3)装置C中发生催化氧化反应的化学方程式为_________________________,装置E发生反应的化学方程式为_________________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有________________________
___________________________________________________________________ __。
__。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:_____________________________________________________________________________________ ____________________________________________________________。
____________________________________________________________。
溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
| 操作 |
预期现象及结论 |
|
| 方案1 |
取少量黄色溶液,加入NaOH溶液 |
如果生成红褐色沉淀,则说明发生了反应 |
| 方案2 |
取少量黄色溶液,加入淀粉碘化钾溶液 |
如果溶液变蓝色,则说明未发生反应 |
| 方案3 |
取少量黄色溶液,加入四氯化碳,振荡 |
如果下层溶液呈橙红色,则说明: |
①方案1是否合理?(填“合理”或“不合理”)。
方案2中,由于存在反应(用离子方程式表示),所以预测结论不正确。
②请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
| 实验操作 |
预期现象及结论 |
解释现象的离子方程式 |
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: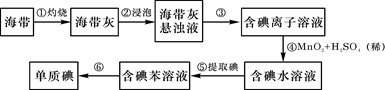
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)步骤④反应的离子方程式是。
此步操作还可以加入更合适的试剂是_________(从下面选择填代号);理由是___
____________________________________________________________________。
A、浓硫酸 B、新制氯水 C、酸化H2O2
(4)步骤⑤中,某学生选择用苯来提取碘的理由是。
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答: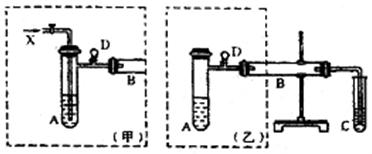
(1)两套装置中的A、B处都需加热,
A处用水浴加热,B处用 加热,A处用水浴加热的主要优点是 ;
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是 ,
B中反应的化学方程式为 。
(3)若按乙装置进行实验,则B管中应装 ,
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,
写出该过程的化学方程式 。
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是 。