有机物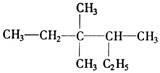 的正确命名为
的正确命名为
| A.2-乙基-3,3-二甲基-4-乙基戊烷 |
| B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基已烷 |
| D.2,3,3-三甲基已烷 |
有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1。要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2 mol·L-1的NaOH溶液的体积为( )
| A.80 mL | B.100 mL | C.120 mL | D.140 mL |
下列物质不能通过化合反应直接制得的是( )
| A.FeCl2 | B.NaHCO3 | C.Cu(OH)2 | D.Fe(OH)3 |
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是 ( )
| A.镁粉只直接与溴水中的溴反应 | B.镁粉在水的催化下与溴发生反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 | D.镁粉只与溴水中的酸反应 |
在浓盐酸中HNO2与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2HNO2+6H+===N2↑+3SnCl+4H2O关于该反应的说法中正确的组合是( )
①氧化剂是HNO2 ②还原性:Cl->N2
③每生成2.8 g N2,还原剂失去的电子为0.6 mol ④x为4,y为2 ⑤SnCl是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
下列说法不正确的是( )
A.磷酸的摩尔质量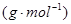 与6.02×1023个磷酸分子的质量(g)在数值上相等 与6.02×1023个磷酸分子的质量(g)在数值上相等 |
| B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1 |
| C.32 g氧气所含的原子数目为2NA |
| D.常温常压下,0.5 NA个一氧化碳分子所占体积是11.2 L |