在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
(12分)X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,交警可以用H2SO4酸化的K2Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式 。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
(2分)冶炼金属的三种常用方法是:①热分解法②热还原法③电解法。(填序号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁的常用方法是 。
(13分)烯丙醇(CH2=CH—CH2OH)是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
(1)烯丙醇的分子式为 ;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气__ L。
(3)写出烯丙醇与溴水反应的化学方程式 ,反应类型为___________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为 ,酯化反应生成的产物在一定条
件下可以发生加聚反应得到高分子化合物,其结构简式为 。
(4分)现有:①二氧化碳②甲烷③二氧化硫④氢氧化铜。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中。(填序号)
(1)天然气的主要成分是 ;
(2)医院检验糖尿病要用到的物质是新制的 ;
(3)造成温室效应和全球气候变暖的主要物质是 ;
(4)泄漏到空气中而产生酸雨的主要物质是 。
在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答: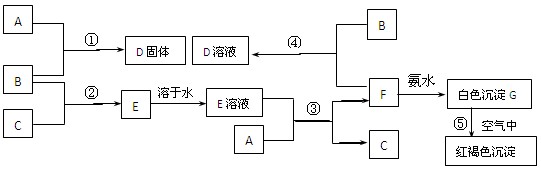
(1)(用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________