铝、铁的混合物溶于足量的盐酸中,再加入过最的NaOH溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.75.7% | C.30.0% | D.80.6% |
下列说法中正确的是
| A.难溶电解质的Ksp越小,溶解度就一定越小 |
| B.一般认为沉淀离子浓度小于1.0×10-5 mol/L时,沉淀就达完全 |
| C.用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
| D.向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组
| 序号 |
① |
② |
③ |
④ |
⑤ |
| 甲 |
CO2 |
HCl |
CO2 |
NO2 |
CO2 |
| 乙 |
SO2 |
CO2 |
SO2 |
SO2 |
NH3 |
| 丙 |
石灰水 |
石灰水 |
Ba(NO3)2 |
BaCl2 |
CaCl2 |
A、①②③④⑤ B、②③④⑤ C、①③④ D、①②③④
下列离子方程式正确的是
| A.三氯化铝溶液中加入过量氨水:Al3++3OH-==Al(OH)3↓ |
| B.向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2==10Cl-+4I2+2Fe3+ |
C.K37ClO3与浓盐酸(HCl)在加热时生成Cl2: +6HCl +6HCl 37Cl-+3Cl2↑+3H2O 37Cl-+3Cl2↑+3H2O |
D.将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++ ==CO2↑+H2O ==CO2↑+H2O |
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是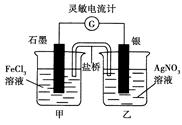
| A.盐桥中的K+移向乙烧杯 |
| B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| C.在外电路中,电子从石墨电极流向银电极 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2+M = NiOOH+MH已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法正确的是
| A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-= Ni(OH)2+OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O+M+e-= MH+OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |