用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 |
操作及现象 |
溶液 |
| A |
通入CO2,溶液变浑浊 |
饱和Na2CO3溶液 |
| B |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
Na2SiO3溶液 |
| C |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
澄清石灰水 |
| D |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
下列说法正确的是
| A.水解反应是吸热反应 | B.升高温度可以抑制盐类的水解 |
| C.正盐水溶液的pH均为7 | D.酸式盐的pH均小于7 |
下列离子方程式中属于水解反应的是
A.Cl2+H2O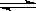 H++Cl-+HClO H++Cl-+HClO |
B.HS—+OH—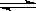 S2—+H2O S2—+H2O |
C.HCO3—+H2O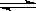 H3O++CO32— H3O++CO32— |
D.NH4++H2O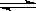 NH3·H2O+H+ NH3·H2O+H+ |
已知:H2(g)+F2(g)="2HF(g)" △H=-270kJ/mol,下列说法正确的是
| A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 |
| B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量 |
在石灰乳中存在平衡体系:Ca(OH)2(s)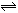 Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量CaO固体 |
下列事实能用勒夏特列原理解释的是
| A.合成氨工业采用高温条件 |
| B.配制FeSO4溶液时在溶液中加入稀硫酸 |
| C.H2、I2、HI 平衡混合气体加压后颜色变深 |
| D.工业制硫酸中,SO2氧化成SO3,往往需使用催化剂 |