现用质量分数为98%、密度为1.84g•cm3的浓H2SO4配制500mL、0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有____________(填代号).配制时还欠缺的仪器是___________。
(2)经计算,需浓H2SO4的体积为____________mL(精确到0.1)。
(3)配制过程有以下操作:
A 移液 B 量取 C 洗涤 D 定容 E 溶解 F 摇匀
其正确的操作顺序应是_________________(填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有__________(填代号)
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)=____________。
(8分) 50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题: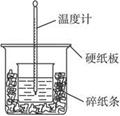
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是.
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1的盐酸跟60 mL 0.55 mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_________________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会___________(均填“偏大”“偏小”“无影响”)。
为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取Wg草酸晶体,配成100.00mL溶液。
②取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4,用amol/L KMnO4溶液滴定。
试回答:
(1)写出滴定过程中反应的化学方程式:。
(2)实验中,标准液KMnO4应装在(填“酸式”或“碱式”)滴定管中。滴定终点时溶液由
色变为色,且在30s内颜色不再恢复为原来颜色。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x值会(填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用去amol/L KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为
mol/L,由此x=。
(5)若滴定终点读数时俯视,则计算的x值会(填“偏大”、“偏小”或“无影响”)。
(1)某小组设计如图所示的装置图:(图中夹持装置略去),分别研究SO2和Cl2的性质。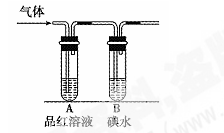
①若从左湍分别通入SO2和Cl2,装置A中观察到的现象(填“相同”或“不相同”);若通入气体为Cl2,解释A中产生相应现象的原因。
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为____。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量(填字母),能产生白色沉淀。
| A.氨水 | B.稀盐酸 | C.硝酸钾溶液 | D.硫酸钠溶液 |
(3)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应: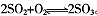 。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过某物质的溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。反应达到平衡时SO2的转化率(计算结果保留到0.1010)。
。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过某物质的溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。反应达到平衡时SO2的转化率(计算结果保留到0.1010)。
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如下图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为____极,其电极反应式为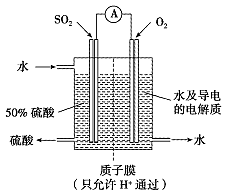
铬铁矿是最难分解的矿石之一,加工前需将矿样充分粉碎。其主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
请回答:
(1)煅烧前应将铬铁矿充分粉碎,其目的是____。灼烧是中学化学中常用的操作方法。如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要的有。
| A.陶瓷坩埚 | B.铁坩埚 | C.三脚架 | D.泥三角 |
(2)煅烧过程中FeO·Cr2O3发生反应的化学方程式是。
(3)制备过程中杂质SiO2、Al2O3最终分别以(写化学式)____、____的形式被除去。
(4)向黄色的滤液2中加稀硫酸,观察到溶液逐渐变为橙色。请结合化学平衡原理和必要的文字,对此过程给予合理解释。
(5)向Na2Cr2O7溶液加入KC1固体,获得K2Cr2O7晶体能庙橐作并衣次是:加热浓缩、____、过滤、洗涤、干燥。
某化学小组以苯甲酸为原料制取苯甲酸甲酯。已知苯甲酸25℃时的溶解度为0.35g。
I.制取苯甲酸甲酯: 实验装置如下: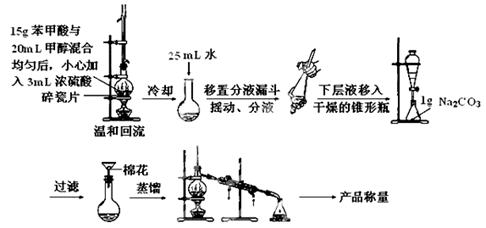
(1)写出制取苯甲酸甲酯的化学方程式:。
(2)第一步温和回流制备苯甲酸甲酯时,冷凝管的冷却水的进口为_____口(填“上”或“下”),冷凝管的作用为___________________,这样做的好处为___________________________________。
(3)根据化学计量数之比,反应物甲醇应过量,其理由是。
(4)冷却后的粗产品中加入25mL水的目的是__________________________________________,将分液后的下层液体加入到1g Na2CO3中的目的是:①吸收酯中的水并抑制酯的溶解;
②。
Ⅱ.苯甲酸甲酯有多种同分异构体,其中一种同分异构体在苯环上有两个相邻侧链且与苯甲酸甲酯具有相同官能团;写出该化合物与足量NaOH溶液共热的化学方程式: