铬铁矿是最难分解的矿石之一,加工前需将矿样充分粉碎。其主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
请回答:
(1)煅烧前应将铬铁矿充分粉碎,其目的是 ____。灼烧是中学化学中常用的操作方法。如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要的有 。
| A.陶瓷坩埚 | B.铁坩埚 | C.三脚架 | D.泥三角 |
(2)煅烧过程中FeO·Cr2O3发生反应的化学方程式是 。
(3)制备过程中杂质SiO2、Al2O3最终分别以(写化学式)____、____的形式被除去。
(4)向黄色的滤液2中加稀硫酸,观察到溶液逐渐变为橙色。请结合化学平衡原理和必要的文字,对此过程给予合理解释 。
(5)向Na2Cr2O7溶液加入KC1固体,获得K2Cr2O7晶体能庙橐作并衣次是:加热浓缩、____、 过滤、洗涤、干燥。
甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论。限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 |
|
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的 溶液。 |
若溶液褪色,说明其有 若溶液不褪色,说明其中没有 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加 溶液。 |
如果有白色沉淀生成,则说明其中有 ,已经变质。 如果没有白色沉淀生成,则说明其中没有 |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml (填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数= (只列出计算式,不要求算出结果)
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)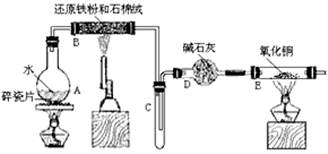
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 __________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下: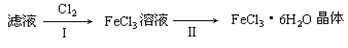
① 步骤I中通入Cl2的作用是____________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
现用质量分数为98%、密度为1.84g•cm3的浓H2SO4配制500mL、0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒②烧瓶③烧杯④药匙⑤量筒⑥容量瓶⑦托盘天平。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有____________(填代号).配制时还欠缺的仪器是___________。
(2)经计算,需浓H2SO4的体积为____________mL(精确到0.1)。
(3)配制过程有以下操作:
A移液 B量取 C洗涤D定容 E溶解F摇匀
其正确的操作顺序应是_________________(填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有__________(填代号)
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)=____________。
有一包从海水获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
探究一:这包粗盐中还有什么杂质?估计还含有氯化钙和氯化镁。
(1)现用实验验证推测:取样并溶解,加入几滴氢氧化钠溶液,目的是检验有没有___________________,接着再加数滴碳酸钠溶液,目的是检验有没有____________________。实验证明含有的杂质是氯化钙。
探究二:这包粗盐中氯化钠的质量分数是多少?接下面步骤继续实验:
①称取一定质量样品;
②将样品加水溶解;
③向粗盐溶液加入过量的某种试剂,过滤;
④沉淀洗涤后小心烘干,得到纯净固体A;
⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;
⑥称量实验中得到的某种固体。
(2)在②③⑤的步骤中,都使用到的同一仪器是____________,它在步骤②和⑤的操作方法相同,但目的不同,在步骤②的目的是_____________________,步骤⑤的目的是________________。
(3)在步骤③中加入的试剂是________________
(4)步骤⑥中,你认为需要称量的固体是A还是B____________
(一)酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。某学生用0.1032 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)重复三次的实验数据如下表所示:
| 实验序号 |
消耗0.1032 mol·L-1的氢氧化钠溶液的体积/mL |
待测盐酸溶液的体积/mL |
| 1 |
28.84 |
25.00 |
| 2 |
27.83 |
25.00 |
| 3 |
27.85 |
25.00 |
则待测HCl的物质的量浓度是________mol·L-1。
(3)滴定至终点的现象是 。
(4)下列操作中可能使所测盐酸的浓度数值偏低的是 。
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为 。
(二)从海水中提取溴的工业流程如图: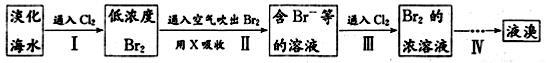
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。
(2)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。