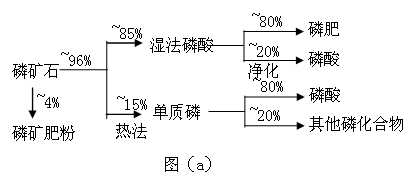
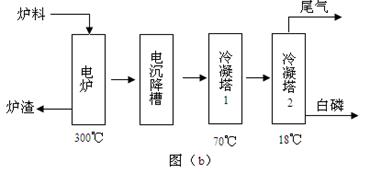
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca5F(PO4)3、Ca5(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
| |
熔点/℃ |
沸点/℃ |
备注 |
| 白磷 |
44 |
280.5 |
|
| PH3 |
-133.8 |
-87.8 |
难溶于水,具有还原性 |
| SiF4 |
-90 |
-86 |
易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 %。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式) ,冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(1)方案一:称取一定质量的样品(10g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为10.8g,计算。①实验中加热至恒重的目的是。②样品中Na2CO3的质量分数为
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
①已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是____________________。
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中________,E中________。(各1分)
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是______________。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是_________。
(13分)有一白色固体混合物,可能含有的阴、阳离子分别是
| 阳离子 |
K+ Ba2+ Ag+ Mg2+ NH Na+ |
| 阴离子 |
SO SO CO AlO |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试 纸测得溶液的pH为12。
纸测得溶液的pH为12。
| 排除的离子 |
排除的依据 |
| NH Ag+、Mg2+ |
由于溶液呈碱性,且未嗅到刺激性气味,碱性溶液中无沉淀生成 |
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
| 肯定存在的离子 |
|
| 简述判断依据 |
|
| 排除的离子 |
|
| 简述排除的依据 |
(3)尚待检验的离子及其检验方法
| 尚待检验的离子 |
|
简述 检验方法 检验方法 |
用下图装置可证明CO2与NaOH溶液发生了反应:
(1)将A与B连接,打开止水夹将胶头滴管中的液体挤入烧瓶,此时的现象是,反应的离子方程式_______。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该固体的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3; 假设2:该固体只有Na2CO3;
假设2:该固体只有Na2CO3;
假设3:该固体只有。
假设4:该固体为____________。
②.请设计实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的现象和结论。(步骤可不填满也可增加)
限选的试剂、仪器: 1moL·L–1HCl、1mol·L–1 MgCl2、0.5moL·L–1BaCl2和1mol·L–1 Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置。
| 实验步骤 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
(可能用到的原子量:Cl 35.5 Ca40 O 16 )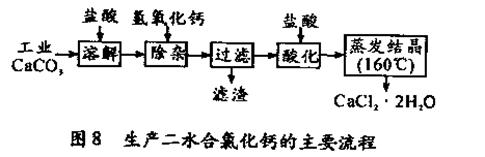
(1)CaCO3与盐酸反应的离子方程式。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。滤渣主要成分的化学式。
(3)酸化时加盐酸的目的为:
①,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发结晶要保持在160℃: 。
。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数。(只写计算式不计算结果)。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
(16分) 图Ⅰ是实验室中常用于制备和干燥气体的装置: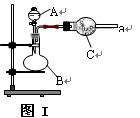
(1)甲同学用图Ⅰ装置、铜和浓硝酸制备并收集干燥的NO2气体:
① B中反应的化学方程式__________ ___________________。
___________________。
② 收集NO2气体的方法;
③ 将收集满NO2的烧瓶密封浸入冰水中,烧瓶内气体颜色变浅,则下列反应:
2NO2 (g)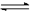 N2O4(g)ΔH 中的ΔH0(填“>”或“<”)
N2O4(g)ΔH 中的ΔH0(填“>”或“<”)
(2) 乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质:
往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→ b→c→ h连接各仪器 :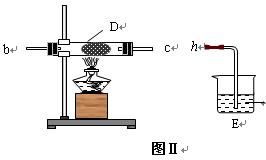
① 实验中观察到D内有红棕色气体出现,证明氨气具有____(填“氧化性”或“还原性”)。
② D中反应的化学方程式为_____________________、.
③为防止NO2 污染环境,E装置中装的试剂可以是。