下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。

(1)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞:
① 锥形瓶内产生的气体主要有(写化学式) 。
② 用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右连接顺序是(填字母)( )→( )→( )→E
③试管B中的现象为 ,反应方程式为 。
(2)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。
①此实验的目的是 ,
D装置的作用是 。
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有 。(写出一种即可)
③加热前必须进行的操作是 。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: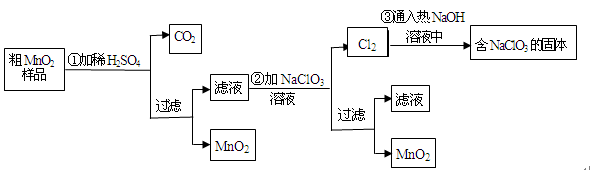
(1)第①步加稀H2SO4时,粗MnO2样品中的_________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:□+□ +□=□MnO2↓+□Cl2↑+□
+□=□MnO2↓+□Cl2↑+□
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、________、________、________,
已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要________mol NaClO3。
NaHCO3是重要的化工原料,在实验室里可通过下列两个步骤得到:
已知一些物质在20℃、30℃时溶解度数据:
 溶解度(g) 溶解度(g)温度(℃) |
NH4Cl |
NH4HCO3 |
NaHCO3 |
NaCl |
Na2CO3 |
(NH4)2CO3 |
| 20 |
28.7 |
21.7 |
9.6 |
31.5 |
21.5 |
100 |
| 30 |
41.1 |
27.0 |
11.1 |
36.3 |
39.7 |
>100 |
请回答:
(1)步骤Ⅰ反应的化学方程式是。
(2)若将NH3和CO2两种气体通入顺序互换后没有沉淀,原因是。
(3)步骤Ⅱ所得白色沉淀中一定有NaHCO3,原因是。
(4)步骤Ⅱ生成NaHCO3的离子方程式是。
(5)根据气体物质溶解性及上列溶解度数据,简述上述两过程在较低温度下进行时效果更好的原因。
某研究小组为了探究Fe3+与I-的反应是否为可逆反应,设计了如下实验:
(1)取少量溶液1于试管中,加入少量淀粉溶液,震荡,溶液变蓝,说明Fe3+与I-的反应有______________生成(填化学式)。
(2)上述操作1的名称:______________,所用的主要仪器是_____________,上层溶液的颜色为________________。
(3)该小组对下层溶液滴加KSCN溶液未见红色的原因,提出了下列两种猜想。
猜想一:___________________________;
猜想二:残留的Fe3+与SCN-结合生成的Fe(SCN)3浓度极小,其溶液颜色肉眼无法观察。
为了验证猜想,在查阅资料后,获得下列信息:
Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
(4)若猜想1成立,请写出该反应的离子方程式:______________;
(5)若猜想2成立,请自行设计实验验证。
| 实验步骤 |
预期现象与结论 |
(15分)纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油扭、涂料、密封胶与胶粘剂等行业。在浓CaCl2,溶液中通人NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有他稀硫酸的脱脂棉.图中夹持装置已略去。
I.可选用的药品有:a.石灰石b.饱和氯化钙溶液c.6 mol/L盐酸d.氯化铵固体e.氢氧化钙固体。
(1)A中制备气体时,所需药品是(选填字母序号)______________;
(2)B中盛有_________溶液,其作用是_____________;
(3)写出制取氨气的化学方程式_____________________;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入的气体是_____(写化学式)
(5)检验D出口处是否有氨气逸出的方法是_______________________;
(6)写出制取纳米级碳酸钙的化学方程式________________________。
(12分)某混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Al3+、Ba2+、CO32-、SO42-、Cl-、Br-。现分别取100 mL的三等份溶液进行如下实验:
①第一份加过量浓NaOH溶液加热后,收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。再向甲溶液中通人过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
②第二份加足量盐酸酸化的BaC12溶液,经过滤、洗涤、干燥后,得到沉淀的质量为11.65 g,
③第三份加CCl4,滴加少量氯水,振荡后静置, CCl4层未变红色;
依据实验回答下列问题:
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类。
实验①可以确定:一定存在的离子有__________,一定不存在的离子有___________;
实验②可以确定:一定存在的离子有___________________,一定不存在的离子有________;
实验③可以确定:一定不存在的离子有_____________________。
(2)试通过分析与计算,原溶液中K+的物质的量浓度为____________mol·L-1。