全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
(1)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min);
②氢气平衡时的物质的量浓度为___________;
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________.
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol CO2和3mol H2 |
④当反应达到平衡时, H2的物质的量浓度为c1,然后向容器中再加入1mol CH3OH和1mol H2O,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1______c2的关系(填>、<、=).
(2)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率___________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12Lb.>1.12Lc.<1.12L
物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
(1)Y是 (化学式)。
(2)将X与Y混合,可生成淡黄色固体,书写相关化学方程式 。
(3)将X的水溶液久置于空气中会变浑浊,说明X具有 性质。
(4)烧杯中加一些蔗糖,滴几滴水,并倒入一些W的浓溶液,用玻璃棒搅拌,观察到的所有现象为 ,说明W的浓溶液具有 、 和 性质。
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是 (填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4 d.SO2 + Na2SO4
【化学-选修3:物质结构与性质】
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为________________。
(2)AB2分子中,A的杂化类型为________________;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)__________________。
(3)B的氢化物与D的氢化物的沸点较高的是____________(用化学式表示),原因是______________。
(4)AB2形成的晶体的熔点____________(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是___________________。
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为____________(用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:_________________________。
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为____________g/cm3.(已知阿伏加德罗常数为NA)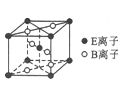

“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。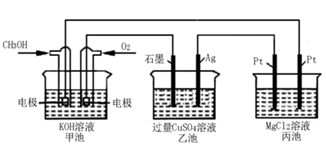
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H="a" kJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H="b" kJ•mol﹣1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H= kJ•mol﹣1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为 .
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2═17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 .
②在6.0mol•L﹣1HCl溶液中,混合物Y能完全释放出H2.1mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 .
③在0.5 mol•L﹣1NaOH和1.0 mol•L﹣1MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质X﹣射线衍射谱图如下图所示(X﹣射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式).
(3)铝电池性能优越,Al﹣AgO电池可用作水下动力电源,其原理如右下图(图2)所示.该电池反应的化学方程式为: .