对于下列反应类型的判断,不正确的是
| A.2FeCl2+Cl2====2FeCl3(化合反应) |
B.3CO+Fe2O3 2Fe+3CO2(置换反应) 2Fe+3CO2(置换反应) |
C.2KClO3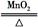 2KCl+3O2↑(氧化还原反应) 2KCl+3O2↑(氧化还原反应) |
D.H2CO3 CO2↑+H2O(分解反应) CO2↑+H2O(分解反应) |
短周期元素X、Y、Z、W、Q在元素周期表的位置如下表所示,
其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
| A.钠与Y可能形成Na2Y2化合物 |
| B.由Z与Y组成的物质在熔融时能导电 |
| C.单质的沸点:W < Q |
| D.X有多种同素异形体,而Y不存在同素异形体 |
如图表示物质通过一步反应的转化关系,下列说法正确的是
X(单质或化合物)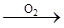 酸性氧化物
酸性氧化物 酸
酸
| A.X可能是Al |
| B.X可能是H2 |
| C.酸性氧化物可能是SiO2 |
| D.酸可能是H2SO4 |
下列各组性质的比较中正确的是
| A.酸性 HClO4<HBrO4<HIO4 |
| B.碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 |
| C.稳定性 HCl>PH3>H2S |
| D.还原性 Cl->Br->I- |
同主族元素形成的同一类型化合物,往往其结构和性质相似。化合物PH4I是一种无色晶体,下列对它的描述正确的是
| A.它是一种共价化合物 |
| B.在加热条件下不能产生有色气体 |
| C.它能与NaOH溶液反应 |
| D.该化合物中每个原子都能满足8电子稳定结构 |
下列说法正确的是
| A.原子的电子层数越多,原子半径越大 |
| B.同族元素原子序数之差可能为16、26、36、46 |
| C.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D.卤族元素的单质均有氧化性,最高正价都是+7 |