利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)右图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)。
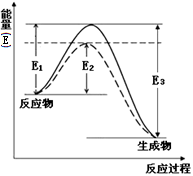
该图中的实线与虚线部分是什么反应条件发生了变化? 。
(2)在一定温度下,若将4amol H2和2amol N2放入VL的定容密闭容器中,2分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为 摩尔/(升–秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (填“正向移动”“逆向移动”或“不移动”)。
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒物质的量大小排列为:
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是 。
a.c(NH4+)/c(NH3•H2O) b.c(NH3•H2O)/c(OH-)
c.c(OH-)/c(H+) d.c(H+)/c(NH4+)
铝是一种重要的金属,在生产、生活中具有许多重要的用图,如图是从铝土矿中制备铝的工艺流程:
已知:
①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)溶解铝土矿时,其成分与NaOH溶液发生反应的离子方程式: .
(2)滤渣A的主要成分为 ;硅酸盐沉淀写成氧化物的形式是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 .
(4)若该工厂用mkg铝土矿共制得nkgAl(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 .
(5)若将铝用酸溶解,下列试剂中最好选用 (填编号).
| A.浓硫酸 | B.稀硫酸 | C.稀HNO3 | D.浓HNO3 |
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 ,配位数为 .
某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O2等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按图1的工业流程进行处理得到溶液(Ⅳ)、电解溶液(Ⅳ)即得MnO2和Zn.
a.操作中①中加Zn粉后发生反应的离子方程式为: 、 .
b.操作②中加入MnO2的作用是 ;反应的离子方程式是 .
c.操作③中所加碳酸盐的化学式是 .
(3)电解法制备高锰酸钾的实验装置示意图(图中阳离子交换膜只允许K+离子通过):
①阳极的电极反应式为 .
②若电解开始时阳极区溶液为1.0L0.40mol/LK2MnO4溶液,电解一段时间后,溶液中 为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10﹣12,Ksp[Cu(OH)2]=2.2×10﹣20,Ksp[Fe(OH)3]=4.0×10﹣38,Ksp[Al(OH)3]=1.1×10﹣33,
①在25℃下,向浓度均为0.1mol•L﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)
②用MgCl2和AlCl3的混合溶液(A)与过量氨水(B)反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 反应物.
③溶液中某离子物质的量浓度低于1.0×10﹣5mol•L﹣1时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol•L﹣1.此时所得沉淀中 (填“还含有”或“不含有”)Al(OH)3.
(1)将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g)=CO2(g)△H=﹣393.0kJ•mol﹣1综合上述信息,请写出CO完全燃烧的热化学方程式 .
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g)△H<0制备.如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线.回答下列问题: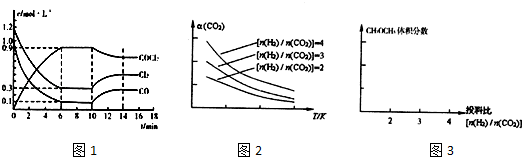
①若保持温度不变,在第8min加入体系中的三种物质各1mol,则平衡 移动(填“向反应正方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6mol/L、c(COCl2)= mol/L,保持反应温度不变则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8) T(15)(填“<”、“>”、或“=”)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)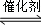 CH3OCH3(g)+3H2O(g).
CH3OCH3(g)+3H2O(g).
①已知一定条件下,该反应中CO2的平衡转化率随温度、投料比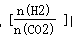 的变化曲线如右上图2.在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比
的变化曲线如右上图2.在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比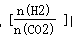 变化的曲线图;
变化的曲线图;
②二甲醚(CH3OCH3)燃料电池可以提升能量利用率.二甲醚酸性介质燃料电池的负极反应式为 .
(4)常温下将amol•L﹣1的醋酸与bmol•L﹣1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO﹣),则混合溶液中醋酸的电离常数Ka= ( 含a和b的代数式表示)
高锰酸钾是中学常用的试剂.工业上用软锰矿制备高锰酸钾流程如下.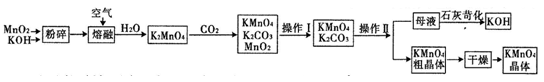
(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式 .
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填代号).
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有 、 (写化学式).
(4)理论上(若不考虑物质循环与制备过程中的损失)1mol MnO2可制得 mol KMnO4.
(5)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 ,所需气体产生装置是 (选填代号).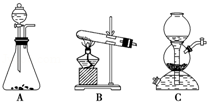
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.
(1)下列物质: ①Na ②Br2 ③Na2O ④NH3 ⑤CO2 ⑥蔗糖 ⑦NaCl晶体 ⑧KCl溶液 ⑨H2SO4 ⑩Ba(OH)2 ,其中属于电解质的是 ,属于非电解质的是 。 (用序号填写)
(2)从Ba(OH)2 、HCl 、Zn 、CuSO4、CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的离子方程式。
①实验室制取CO2的反应 。
②实验室制取H2的反应 。
③生成沉淀的反应 。