(1)某烃A 0.2mol在氧气中充分燃烧后,生成化合物B,C各1.2mol,试回答:
①烃A的分子式为 ,生成的B、C通过足量的过氧化钠可得到O2 _________g。
②若取一定量的烃A燃烧后生成的B、C各3mol,则有 mol烃A参加了以应。
③若烃A不能因反应而使溴的四氯化碳溶液褪色,且A在一定条件下能与氯气发生取代反应,所得一氯化物的结构只有一种,则A的结构简式为 。
④若A为烯烃,则 A的同分异构体有 种。
(2)已知C—C键可以绕键轴自由旋转,结构简式为

①有 个碳原子共线。
②至少 个碳原子共面。
③至多 个碳原子共面。
在工业生产中,X的产量是衡量一个国家石油化工水平发展的标志;G是合成高分子化合物,用于制备塑料。现有如下的反应关系:(部分反应条件和产物已省去)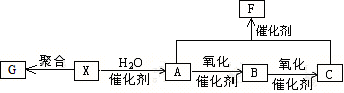
(1)X的结构简式为; A的结构式为。
(2)B中含有的官能团的名称为;X→A的反应类型为。
(3)写出下列转化的化学方程式:X→G ;
A+C→F 。
工业上常用法冶炼铝。铝粉和氧化铁粉末的混合物在高温下的反应被称为反应,设计一个简单实验方案证明上述反应所得的块状融熔物中含有金属铝,该实验所用的试剂是,反应的离子方程式为:。
已知:下列各种物质都由1~18号元素组成,它们之间的关系如下图所示。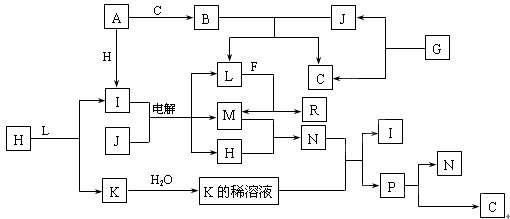
常温下,A、F为金属单质,J是常见无色液体,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R的焰色反应均呈黄色。R的水溶液中滴加盐酸时,刚开始有白色沉淀,后来沉淀又逐渐溶解。请回答:
(1)请写出A与C反应生成B的化学方程式
(2)P不稳定光照易分解成N和C,该反应的化学方程式为
(3)请写出上述电解反应的离子方程式
(4)R与足量盐酸反应的化学方程式为
(5)写出G在MnO2作催化剂条件下分解的化学方程式
2011年“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。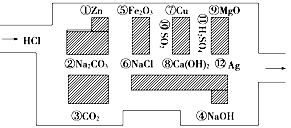
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)___________________________________________________________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有________个,属于氧化还原反应的有________个,其中能“吃掉”盐酸的盐是______________。
(3)如果将盐酸换成氯气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
____________________________________________________________________。
(1)下列物质中属于强电解质的是,属于非电解质是。
①CO2气体②FeCl3溶液③淀粉溶液④NH4Cl晶体⑤蔗糖溶液
⑥铜⑦BaSO4固体⑧CH3COOH⑨NaOH溶液⑩CCl4
(2)写出⑧的电离方程式
(3)⑥与上述某一物质可以发生反应,对应的离子方程式为
(4)如何证明③是胶体?
(5)如何检验④中的阳离子?