硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 |
450 |
500 |
550 |
600 |
| SO2的转化率% |
97.5 |
95.8 |
90.50 |
80.0 |
(1)由表中数据判断△H 0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是
A 容器的压强不变 B 混合气体的密度不变
C 混合气体中SO3的浓度不变 D C(SO2)=C(SO3)
E V正(SO2)=V正(SO3) F V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1.
①0~2min之间,O2的反应速率为 .
②此时的温度为 ℃.
③此温度下的平衡常数为 (可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将 向移动.
石油化工排放的废水中常含有多种还原性物质 。向水样中加入稍过量的重铬酸钾标准溶液,充分反应后,再用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,以检测石油化工废水中还原性物质的含量。
。向水样中加入稍过量的重铬酸钾标准溶液,充分反应后,再用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,以检测石油化工废水中还原性物质的含量。
⑴配制0.010mo1·L-1标准硫酸亚铁铵溶液500 mL时,需称取硫酸亚铁铵晶体[(NH4 )2Fe(SO4)2·6H2O]的质量为g。
)2Fe(SO4)2·6H2O]的质量为g。
⑵硫酸亚铁铵标准溶液在空气中放置后浓度会发生变化,需用重铬酸钾标准溶液标定硫酸亚铁铵溶液的实际浓度。现取0.0040 mo1·L-1重铬酸钾标准溶液10.00 mL,滴定时,用去25.00 mL硫酸亚铁铵溶液,则硫酸亚铁铵标准溶液的实际浓度为(K2Cr2O7的还原产物为Cr3+)。
⑶实际操作中,检测人员在标定标准硫酸亚铁铵溶液浓度时,每次取浓度值为c的重铬酸钾标准溶液10.0 mL,计算时只要测出滴定中消耗的标准硫酸亚铁铵溶液的体积(V,单位mL)就可以依据一个简单的计算式直接计算出标准硫酸亚铁铵溶液的实际浓度。该计算式为。
学校化学实验室一试剂瓶标签严重破损,只能隐约看到一些信息,如图所示。
(1)该物质(M)分子式为:;
(2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下转化: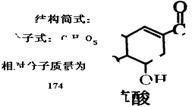

C与F互为同系物,H能使Br2/CCl4溶液褪色,H物质得到的1H-NMR谱中有5个吸收峰。
①A的结构简式为 。
。
②写出一个证明E中官能团的化学方程式 ,反应类型 ;
,反应类型 ;
写出C与D反应生成高聚物的化学方程式,
③写出与H官能团种类和数目都相同的同分异构体任意两个:
针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题: (1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方 程式:。
程式:。 (2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假 设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。
设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。 (3)探究高铁酸钾的某种性质。
(3)探究高铁酸钾的某种性质。 【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。

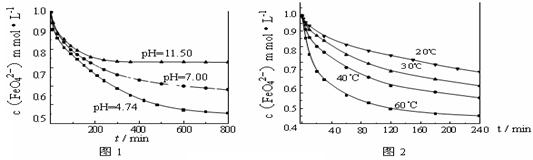

 【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则 ①实验1的目的是;
①实验1的目的是; ②实验2可得出的结论是;
②实验2可得出的结论是; ③高铁酸钾在水
③高铁酸钾在水 中的反应为4 FeO42—+10 H2O
中的反应为4 FeO42—+10 H2O 4 Fe(OH)3+8OH—+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
4 Fe(OH)3+8OH—+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。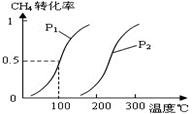
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)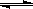 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,
②则用H2表示的平均反应速率为_。图中的P1_ _P2(填“<”、“>”或“=”),
100℃时平衡常数为_ _。
_。
③在其它条件不变时降低温度,逆反应速率将_ _(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)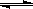 CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④ 该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。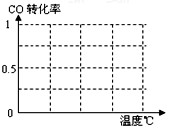
| l实验编号 |
lT(℃) |
ln (CO)/n(H2) |
lP(MP) |
| lⅰ |
l150 |
l1/3 |
l0.1 |
| lⅱ |
l__ |
l__ |
l5 |
| lⅲ |
l350 |
l__ |
l5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
阅读下列信息,推断元素,并按要求回答相应问题: