短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
| A.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| B.氢化物的热稳定性:HnY>HnW |
| C.Y和X、Z和X组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
2SO2(g)+O2(g) 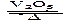 2SO3(g)是制备硫酸的重要反应。下列叙述正确的
2SO3(g)是制备硫酸的重要反应。下列叙述正确的
| A.催化剂V2O5不改变该反应的逆反应速率 |
| B.增大容器体积,反应速率一定增大 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为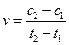 |
反应N2O4(g) 2NO2(g);ΔH="+57" kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH="+57" kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
下列说法正确的是 ( )
| A.在101 kPa、25 ℃时,中和热为57.3 kJ/mol,则表示Ba(OH)2的稀溶液与足量稀硫酸反应的热化学方程式为: Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6 kJ/mol |
| B.在101 kPa、25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量;则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ/mol |
| C.pH=11的氨水和pH=3的盐酸等体积混合,由于NH4Cl水解而使溶液呈酸性 |
| D.在相同情况下,强电解质溶液的导电性比相同浓度弱电解质溶液的导电性强 |
下列方程式书写正确的是()
A.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
B.H2SO3的电离方程式H2SO3 2H++SO32- 2H++SO32- |
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
D.CaCO3的电离方程式:CaCO3 Ca2++CO32- Ca2++CO32- |
工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g) =Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1 (Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是()
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应 |