钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为_________mol/L;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
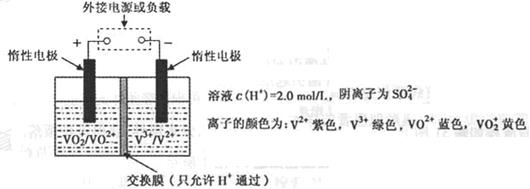
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 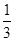 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
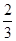 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: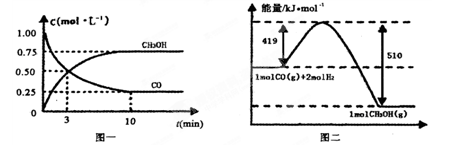
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题: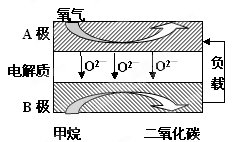
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为(标况下)。
A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强的酸。
(1)推断B在元素周期表中的位置:。
(2)写出A与C形成的10电子的阳离子化学式:。(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是;用电子式表示D2C形成过程
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:(从大到小排列)。
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:
(6)甲是A和C按原子个数比1:1组成的化合物。已知甲的溶液能使酸性高锰酸钾溶液褪色。将含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为
下图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体, E为淡黄色的固体。它们之间有如下转化关系: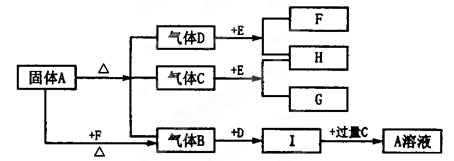
(1)写出A的化学式;C的结构式;
(2)A溶液与过量F溶液反应的离子方程式
根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
(2)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水且V的焰色反应为黄色,离子方程式 ;
②V是水,化学方程式为 。
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni2+的核外电子排布式为。
(2)丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为。丁二酮肟分子中C原子轨道的杂化类型是。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式。